嘉禾一中高二年级期中考试化学试卷
命题:高二备课组 雷光华
时量:90分钟 满分:100分
可能用到的相对原子质量:N:14 H:1 S:32 O:16 Na:
一、选择题(每小题2分,共40分,每小题只有一个正确答案)
1、中小学生经常使用的涂改液中含有挥发性的有毒溶剂,应尽量不使用,以减少对身体的毒害及对环境的污染。该溶剂是( )
A.乙醇 B.乙酸
C.三氯乙烯 D.甘油
2、在申办2008年奥运会期间,北京提出了“绿色奥运”的口号,为改善北京空气质量,将冬季燃煤取暖改用天然气做燃料,这主要是( )
A.减少硫氧化物排放 B.减少氮氧化物排放
C.防止温室效应 D.降低对臭氧层的破坏
3.蛋白质发生的下列过程,可逆的是( )
A.盐析 B.变性 C.煮熟 D.加入浓硫酸
4.下列物质不属于高分子化合物的是( )
A.纤维素 B.淀粉 C.蛋白质 D.油脂
5.正常雨水的PH约为 ( )
A.7.0 B.
6.下列反应中,生成物的总能量大于反应物的总能量的是( )
A.氢气在氧气中燃烧 B.焦炭在高温下与水蒸气反应
C.硫在氧气中燃烧 D.铁丝在氧气中燃烧
7、根据热化学方程式(在101kPa时):S(s)+O2(g)==SO2(g);
△H=-297.23kJ/mol,下列说法中不正确的是( )
A.1mol S完全燃烧时放出的热量为297.23kJ
B.S(g)+O2(g)=SO2(g)放出的热量大于297.23kJ
C.S(g)+O2(g)=SO2(g)放出的热量小于297.23KJ
D.形成1mol SO2的化学键所释放的总能量大于断裂lmol S(s)和1mol O2(g)的化学键所吸收的总能量
8、下列热化学方程式中△H代表燃烧热的是( )
A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g ) △H1
B.S ( s ) + 3/2O2 ( g ) = SO3 ( s ) △H2
C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l ) △H3
D.2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H4
9、已知反应:
①
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热等于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
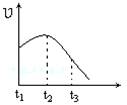 10、将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )
10、将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因是镁与水反应,致使酸的浓度升高
 C.从t2→t3的原因是随着反应的进行镁反应完了
C.从t2→t3的原因是随着反应的进行镁反应完了
D.从t2→t3的原因是随着反应的进行温度越来越低
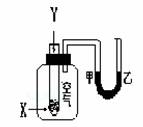
11、某学生用右图所示装置进行化学反应X+2Y==2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升。关于该反应的下列叙述:
①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。其中正确的是( )
A.①②③ B.①③ C.①② D.①
 12、已知299
K时,合成氨反应N2 (g ) + 3H2 (
g ) 2NH3 ( g ) △H= -92.0 kJ/mol,将此温度下的1
mol N2 和3molH2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
12、已知299
K时,合成氨反应N2 (g ) + 3H2 (
g ) 2NH3 ( g ) △H= -92.0 kJ/mol,将此温度下的1
mol N2 和3molH2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
13.同温同压下,下列热化学方程式中Q值最大的是(均为放热反应)
A.
B.
C.
D.
14.下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
15.已知4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是( )
A.4ν(NH3)=5ν(O2) B.5ν(O2)=6ν(H2O)
C.2ν(NH3)=ν(H2O) D.4ν(O2)=5ν(NO)
16. 在密闭容器中,将2.0molCO与10molH2O混合加热到 CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率A.83% B.17% C.50% D.60%
CO2(g)+H2(g) K=1.0 则CO转化为CO2的转化率A.83% B.17% C.50% D.60%
17.反应C(s) + H2O(g)  CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加碳的量②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积增大( )
CO(g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加碳的量②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积增大( )
A.①② B.②③ C.①③ D.①④
18.对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.使用催化剂 B.升高温度 C.增大体系压强 D.加入一种反应物
19.在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为 ( )
A.10% B.20% C.40% D.50%
20.下图为某化学反应的速率与时间的关系示意图。在t1 时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
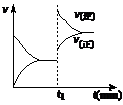 A.2SO2(g)+O2(g)
⇌ 2SO3(g);ΔH<0
A.2SO2(g)+O2(g)
⇌ 2SO3(g);ΔH<0
B.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g);ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g); ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g);ΔH>0
二、填空题(每空2分,共46分)
21.(6分)判断反应进行的方向,必须综合考虑体系的________和________,而________则综合考虑了以上两者对体系的影响(以上三空均用符号表示)。
22.(14分)在密闭容器中的可逆反应CO(g)+NO2(g)
 CO2(g)+NO(g) △H<0达到平衡后:
CO2(g)+NO(g) △H<0达到平衡后:
(1)扩大容器体积,平衡 (填正向移动、逆向移动、不移动),C(NO2)将 _______________(填增大、减小、不变),反应混合物的颜色 (填加深、变浅、不变)。
(2)体积不变,升高温度平衡 (填正向移动、逆向移动、不移动),体系的压强 (填增大、减小、不变)。
(3)加入催化剂,NO的物质的量 (填增大、减小、不变),原因是 。
23.(12分)一定温度下,在容积为 N2O4(g)△H<0,反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(g)△H<0,反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:__________________mol?L-1?s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: _________
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
 (6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
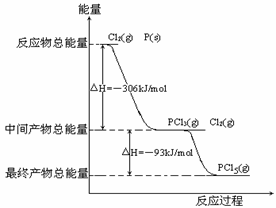
24.(14分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式___________________________。
 (2)PCl5分解成PCl3和Cl2的热化学方程式__________________________,
(2)PCl5分解成PCl3和Cl2的热化学方程式__________________________,
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物
PCl3,然后降温,再和Cl2反应生成PCl5。原因是___________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步
反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
三、实验题(每空2分,共14分)
25.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置
中进行 中和反应。通过测定反应过程中所放出的热量可计算中和热。回答
下列问题:
 (1)从实验装置上看,图中尚缺少的一种玻璃用品是 ___。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ___。
除了上述所缺仪器,该装置还有其它两处错误,请任意指出错误是____________________,___________________________。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 。(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶
液进行反应,与上述实验相比,所放出的热量 (填
“相等、不相等”);所求中和热 (填“相等、不相等”),
嘉禾一中高二年级期中考试化学试卷答卷
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
二、填空题(每空2分,共46分)
21. ________, ________, ________。
22.(1) ____, _______________, _______。
(2) _________, 。
(3) ________, _____________________。
23. (1) (2)__________________mol?L-1?s-1
(3) _________(4) (5) (6)
24. (1) ________________________________________________________。
(2) _____________________________________________________________,
_______________________; _____________________。
(3) _____________________________________________________________。
(4)△H3=________________________________,△H4______△H3。
三、实验题(每空2分,共14分)
25.(1) ___________________,
________________________________________________________________,
________________________________________________________________。
(2) __________________________________。
(3) 。
(4) ___________; ________________,
答案
题号
1
2
3
4
5
6
7
8
9
10
答案
C
A
A
D
C
B
C
C
C
A
题号
11
12
13
14
15
16
17
18
19
20
答案
B
C
C
C
D
A
C
B
C
B
21.△H △S △G
22. (1)不移动,减少,变浅
(2)左移,不变
(3)不变,催化剂不影响平衡
23.(1) (2)0.1 (3)t3(4)
>
(2)0.1 (3)t3(4)
>
(5)正反应应方向 (6)变深
24.(1)P(s)+Cl2(g)===PCl3(g);△H=-306kJ?mol-1。
(2)PCl5(g)===PCl3(g)+Cl2(g);△H=+93kJ?mol-1,25%;大于。
(3)两步反应均为放热反应,降低温度有利于提高产率,防止产物分
解。(2分)
(4)-399kJ?mol-1;(1分)等于。(1分)
25.(l)环形玻璃搅拌棒;在大小烧杯间未填满碎纸条;小烧杯口与大烧杯口未相平 (2)减少实验过程中的热量损失 (3)偏小 (4)不等;相等;