摘要:25.(l)环形玻璃搅拌棒,在大小烧杯间未填满碎纸条,小烧杯口与大烧杯口未相平 (2)减少实验过程中的热量损失 不等,相等,
网址:http://m.1010jiajiao.com/timu_id_185151[举报]
市面上销售的热敷袋种类有很多,如:
(1)可以循环使用的液体热敷袋:该类热敷袋内所装的液体是醋酸钠的过饱和水溶液,使用时仅需轻压热敷袋内的金属片形成结晶核以引发醋酸钠结晶;再生时则仅需将已固化的热敷袋置入热水中(或以微波加热)直至全部晶体溶解后,取出冷却至室温即可再次使用.请认真阅读上面材料,回答以下问题:
①此类热敷袋释放热量的原理是: ;
②热敷袋内溶液溶质结晶的条件是: 、 ;
③若该醋酸钠过饱和溶液恰好完全结晶形成CH3COONa?3H2O,则该过饱和溶液中溶质的质量分数是: .
(2)某种一次性使用的固体热敷袋:使用时从不透气的塑料袋中取出,让内袋(微透气膜)暴露在空气里,能产生40℃~60℃的热度,维持12-20小时.用完后袋内有大量红色物质.为了探究这类热敷袋的主要成分,某兴趣小组开展了如下研究:查阅了有关资料,找到以下两种配方:
i 40g铁粉、20g活性炭、10g氯化钠;
ii 30g铁粉、10g铝粉、15g活性炭、10g氯化钠.
之后,小组同学分别进行如下讨论和实验探究:
①这类热敷袋释放热量的原理是 ;
②在配方中用到的活性炭的作用:其一是利用活性炭疏松结构的强吸附性,吸附空气中的水蒸气形成溶液;其二是 ;
③为了探究配方ii中铝粉的存在,设计了实验方案是:
a、剪开热敷袋,取出少许内容物置于烧杯中,加入稀盐酸,用玻璃棒搅拌充分溶解;
b、 ;
C、
…(可以不填满;步骤若不够,请自行添加)
已知:i茜素-s溶液是Al3+离子特色检验试剂,与Al3+产生玫瑰红色絮状沉淀.
ii Fe3+存在能干扰Al3+的检验
iii 浓度均为4mol?L-1的醋酸-醋酸钠缓冲溶液能将溶液的pH控制在4-5,以沉淀除去Fe3+.
查看习题详情和答案>>
(1)可以循环使用的液体热敷袋:该类热敷袋内所装的液体是醋酸钠的过饱和水溶液,使用时仅需轻压热敷袋内的金属片形成结晶核以引发醋酸钠结晶;再生时则仅需将已固化的热敷袋置入热水中(或以微波加热)直至全部晶体溶解后,取出冷却至室温即可再次使用.请认真阅读上面材料,回答以下问题:
①此类热敷袋释放热量的原理是:
②热敷袋内溶液溶质结晶的条件是:
③若该醋酸钠过饱和溶液恰好完全结晶形成CH3COONa?3H2O,则该过饱和溶液中溶质的质量分数是:
(2)某种一次性使用的固体热敷袋:使用时从不透气的塑料袋中取出,让内袋(微透气膜)暴露在空气里,能产生40℃~60℃的热度,维持12-20小时.用完后袋内有大量红色物质.为了探究这类热敷袋的主要成分,某兴趣小组开展了如下研究:查阅了有关资料,找到以下两种配方:
i 40g铁粉、20g活性炭、10g氯化钠;
ii 30g铁粉、10g铝粉、15g活性炭、10g氯化钠.
之后,小组同学分别进行如下讨论和实验探究:
①这类热敷袋释放热量的原理是
②在配方中用到的活性炭的作用:其一是利用活性炭疏松结构的强吸附性,吸附空气中的水蒸气形成溶液;其二是
③为了探究配方ii中铝粉的存在,设计了实验方案是:
a、剪开热敷袋,取出少许内容物置于烧杯中,加入稀盐酸,用玻璃棒搅拌充分溶解;
b、
C、
…(可以不填满;步骤若不够,请自行添加)
已知:i茜素-s溶液是Al3+离子特色检验试剂,与Al3+产生玫瑰红色絮状沉淀.
ii Fe3+存在能干扰Al3+的检验
iii 浓度均为4mol?L-1的醋酸-醋酸钠缓冲溶液能将溶液的pH控制在4-5,以沉淀除去Fe3+.
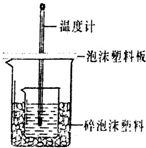 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.(1)该装置中缺少的一种仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
,装置中还存在的错误有大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料
大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料
;大烧杯杯口若不盖泡沫塑料板,测得中和热的数值将偏小
偏小
.(填“偏大”、“偏小”或“无影响”)(2)实验中,所用NaOH稍过量的原因是
确保定量的HCl反应完全
确保定量的HCl反应完全
.(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值
偏小
偏小
(填“偏大”、“偏小”或“不变”).测量NaOH溶液温度时,温度计上的碱未用水冲洗,对测定结果有何影响?无影响
无影响
(填“偏大”、“偏小”或“无影响”).(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如下原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
-56.8 kJ/mol
-56.8 kJ/mol
.(保留到小数点后1位) 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”)(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、不相等”),所求中和热相等
相等
(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(填“偏大”、“偏小”、“无影响”). 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)要重复进行三次实验的目的是
多次测量求平均值可以减少实验误差
多次测量求平均值可以减少实验误差
.(4)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、不相等”),所求中和热相等
相等
(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
.(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(填“偏大、偏小、无影响”).(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
46.3kJ?mol-1
46.3kJ?mol-1
. 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)大烧杯上如不盖硬纸板,求得的中和热数值将
偏小
偏小
(填“偏大”“偏小”或“无影响”).(4)实验中改用60mL 0.50mol/L盐酸跟60mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等”或“不相等”),所求中和热相等
相等
(填“相等”或“不相等”),简述理由因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关;
因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关;
.(5)实验中改用8.0mL 15mol/L硫酸溶液跟60mL 0.55mol/L NaOH溶液进行反应,与上述实验(4)相比,所求中和热
不相等
不相等
(填“相等”或“不相等”),简述理由:浓硫酸稀释要放出热量;
浓硫酸稀释要放出热量;
.