命题 姜幸光 审题 王森淼、吴道伦
【说明:命题范围――《实验化学专题1至专题3》;考试时间――90分钟】
一、选择题(每小题只有一个正确答案,每小题2分,共42分)
1、如果你家里的食用花生油混有了水,你将采用下列何种最佳方法分离它们
A.过滤 B.蒸馏 C.分液 D.萃取
2、离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子检验的方法不合理的是
A.NH4+ - 气体法 B.I- - 沉淀法 C.Fe3+ - 显色法 D.SO42- - 气体法
3、在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层为无色,下层为紫红色 D.下层无色,上层紫红色
4、以下措施能使层析实验达到较好分离效果的是
A.配制时试样溶液的浓度较大,点样时试样点斑较小
B.配制时试样溶液的浓度较大,点样时试样点斑较大
C.配制时试样溶液的浓度较小,点样时试样点斑较小
D.配制时试样溶液的浓度较小,点样时试样点斑较大
5、铁离子和铜离子能够在滤纸条上彼此分离开的原因是
A.二者在混合溶液试样中已经分开
B.阳光的照射使两种离子彼此分开
C.滤纸对两种离子的吸附力不同
D.展开剂(丙酮和盐酸)使两种离子分离的扩散速度不同
6、牙膏中含有不溶于水的成分,如碳酸钙、磷酸钙、氢氧化铝、二氧化硅等,它们的主要作用是 A.固定剂 B.发泡剂 C.摩擦剂 D.防腐剂
7、以下过滤操作中,不正确的是
A.滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡
B.漏斗下端管口应紧靠烧杯内壁
C.倒入漏斗的过滤液的液面应高于滤纸边缘
D.要沿着玻璃棒慢慢向漏斗中倾倒过滤液
8、某同学欲检验火柴燃烧后的气体中是否含有CO2,他应采用下列方法中的
A.通入澄清的石灰水 B.先通入足量NaHCO3溶液,再通入澄清石灰水
C.通入品红溶液 D.先通入足量溴水,再通入澄清石灰水
9、下列关于牙膏的说法中不正确的是
A.牙膏中加甘油作保湿剂
B.用含氟牙膏刷牙可使牙齿坚固,从而有效防止蛀牙,故牙膏中的氟含量越高越好
C.牙膏中的增香剂和甜味剂可改善牙膏的口感
D.牙膏中的着色剂可使牙膏变白或呈现出不同的颜色
10、 向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是
A.部分为 Al(OH)3沉淀,部分以Al3+形式存在 B.部分为Al(OH)3,部分为[Al(OH)4]-
C.全部为Al(OH)3沉淀 D.全部以[Al(OH)4]-形式存在
11、有100mL 3mol / L氢氧化钠溶液和100mL 1mol / L氯化铝溶液。按如下两种方法进行实验①将氢氧化钠溶液分多次加入到氯化铝溶液中
②将氯化铝溶液分多次加入到氢氧化钠溶液中, 比较两次实验结果。
A.现象相同, 最终沉淀量相等 B.现象不同, 最终沉淀量不等
C.现象相同, 最终沉淀量不等 D.现象不同, 最终沉淀量相等
12、在盛有1mL1mol.L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol/L
氨水,没有生成白色沉淀,其原因是
A.溶液的碱性不够强 B. Al3+不与氨水反应
C.生成的Al(OH)3溶解了 D. Al3+几乎都与F-结合生成新物质了
13、亚硝酸钠有咸味、有毒,外观类类似于食盐,故应严防把它误当作食盐用。下列用于区别亚硝钠与食盐的方法正确的是
A.用甲基橙指示剂 B.观察晶体的色态
C.测试溶液的pH D.品尝溶液的味道
14、关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
15、下列能鉴别碳酸钠、氯化钠、溴化钠、亚硝酸钠四种固体物质的是
A.稀硝酸 B.硝酸酸化的硝酸银
C.稀硫酸 D.氯化钡溶液和盐酸
16、下列实验操作或原理不正确的是。
A.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象。
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒。
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大。
D.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口。
17、在制备硝酸钾晶体实验中,先后进行了二次过滤,分别是
A.先常温常压过滤,后高温常压过滤 B.先高温常压过滤,后常温减压过滤
C.先常温减压过滤,后高温常压过滤 D.先高温常压过滤,后常温常压过滤
18、下表中实验操作能达到实验目的的是
实验操作
实验目的
A
将乙醇滴加到酸性KMnO4或K2Cr2O7溶液中
证明乙醇具有氧化性
B
向苯酚的饱和溶液中滴加稀溴水
制备三溴苯酚
C
向乙醚和苯酚的混合液中加入金属钠
确定乙醚中混有苯酚
D
将氯水加入浸泡过海带灰的溶液中
使溶液酸化
19、利用重结晶的方法除去某产品中杂质,要选择合适溶剂。溶剂的下列特点中不可取的是
A.杂质在溶剂中的溶解度常温或加热时都很大 B.在常温时,产品在溶剂中易溶
C.产品在溶剂中的溶解度随温度升高而迅速加大 D.在同一溶剂中,产品比杂质易溶
20、下列实验操作正确的是
A.不慎将苯酚沾到皮肤上,先用NaOH稀溶液冲洗,再用大量的清水冲洗
B.在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.钠与水的反应:用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
21、实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用Ba(OH)2溶液后,应把它放回的位置是
二、简答、实验题(有6小题,共58分)
22、(5分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 。
(2)固体和液体的分离 。
(3)含固体溶质的溶液中除去部分溶剂 。
(4)胶体中分离出可溶电解质 。
(5)几种沸点相差较大的互溶液体的分离 。
23、(5分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 。
(2)若A为1mol/LH2SO4溶液,B为Na2CO3,C盛有苯酚钠饱和溶液,旋开E后,C中出现浑浊的现象,写出C中发生反应的化学方程式为 ,然后往烧杯中加入沸水,又可观察到的现象是____ _____。
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为 。
24、(10分)将铝片(不除氧化膜)投入的浓硫酸铜溶液中,在短时间内铝片无明显变化。若用同样的铝片投入同浓度氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上又出现大量气泡。触摸容器壁知溶液温度迅速升高,收集气体,检验其具有可燃性,继而产生蓝色沉淀,混合液温度升高甚至发烫,产生气泡速率明显加快,铝片上下翻滚,溶液中出现黑色物质……
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不发生反应的原因可能是
A.氯化铜溶液的酸性比同浓度的硫酸铜溶液强
B.硫酸铜溶液水解产生的硫酸使铝钝化
C.氯离子能破坏氧化铝薄膜而硫酸根不能
D.生成的氯化铝能溶于水而生成的硫酸铝难溶于水
(2)铝片表面出现的暗红色物质是 ,产生该物质的离子方程式是
(3)放出的气体是 ,请产生的蓝色沉淀是 ,可用来说明该现象产生原因的离子方程式为 ;
(4)某学生通过一定实验操作,使铝片与硫酸铜溶液的反应也能较快进行,他采取的措施可能是
A.用砂纸擦去铝表面的氧化膜后投入硫酸铜溶液中
B.把铝放在氢氧化钠溶液中加热一段时间后,取出洗净投入
C.向硫酸铜溶液中加入少量氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)溶液中出现的黑色物质可能是 ,产生该物质的化学方程式为 。
25、 (12分) 牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图。
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)已知邻二醇与新制的氢氧化铜悬浊液反应生成绛蓝色溶液,写出④中发生反应的化学方程式: 。
(4) 将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是:
、 (任答两条)。
(5) 在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
26、(12分)
已知几种盐的溶解度随温度变化的曲线如下图所示:
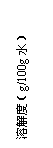 |
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,滴加过量Ba(NO3)2溶液,过滤后向滤液滴加硝酸酸化的AgNO3溶液。判断Ba(NO3)2已过量的方法是 。
27、(14分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
请回答以下问题:
(1)为验证气体A,按右图所示进行实验:若能观察到
的现象,即可证明火柴头上含有S元素;
可用于替代试管中酸性高锰酸钾溶液的试剂有
(填标号)
A.品红溶液 B.饱和石灰水
(2)步骤②的实验操作装置如右下图所示,其中仪器A的名称
是 ,仪器B的名称是 ,
该操作的工作原理是
。
(3)要证明火柴头中含有Cl元素的后续实验步骤是
。
(4)有学生提出检验火柴头上KClO3另一套实验方案:
有关的离子反应方程式为 ,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是 。
(5)写出步骤 ① 中发生反应的化学方程式 。

题号
1
2
3
4
5
6
7
8
9
10
11
答案
题号
12
13
14
15
16
17
18
19
20
21
答案
二、简答、实验题(有6小题,共58分)
22、(1) 。(2) 。(3) 。(4) 。(5) 。
23、(1)
(2) 、
(3) 、
24、(1) (2) 、
(3) 、 、
(4) (5) 、
25、(1) 、
(2)
(3)
(4) 、 (5)
26、(1)
(2) 、
(3) 、
(4)
27、(1) 、
(2) 、 、
工作原理是:
(3)后续实验步骤是
(4)离子方程式: 、
理由:
(5)
高二化学期中考试答案
题号
1
2
3
4
5
6
7
8
9
10
11
答案
C
D
C
A
D
C
C
D
B
D
D
题号
12
13
14
15
16
17
18
19
20
21
答案
D
C
C
B
C
B
C
A
B
D
一、选择题
22、(1)分液 (2)过滤 (3)蒸发 (4)渗析 (5)蒸馏(或分馏)
(各1分,错别字不给分)
23、 (1)防倒吸;
(2)C6H5ONa + H2O + CO2 → C6H5OH + NaHCO3 溶液又变澄清
(3)有白色沉淀生成 Al3+ + 3NH3?H2O=Al(OH) 3↓ + 3NH4+ (各1分)
24、(其中第(4)题为2分,其余每一空格为1分)
(1)C
(2)Cu 2Al + 3 Cu2+ = 2Al3+ + 3 Cu
(3) H2 Cu(OH)2 3Cu2++6H2O+2Al=3Cu(OH)2+3H2+2Al3+ (分步书写也可以)
(4)AB
(3)
(2分)
(4) CO2 过量;石灰水不足;CO2气体中混有挥发出来的HCl。 (任2项,共2分)
(5) 草酸铵 (2分)
26、(12分)
(1)Fe2+ (1分)
(2)4FeCO3+O22Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、趁热过滤、洗涤、干燥(3分)
(4)取少许滤液于另一试管中,再滴入1~2滴H2SO4溶液,若溶液变浑浊。则表明Ba(NO3)2已过量。(3分)
27、(14分)(1)KMnO4溶液(紫红色)褪色(1分) AC(1分)
(2)布氏漏斗(1分) 吸滤瓶(1分)
工作原理是:当打开自来水龙头,装置内部的空气随自来水被带走,导致装置内部压强减小,使过滤速度加快,得到较干燥的固体物质。(2分)
(3)取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素。(2分)
(4)ClO3¯+3NO2¯+Ag+=AgCl↓+3NO3¯(2分)
AgNO2与AgCl均为不溶于水的白色沉淀。(2分)
2KCl+3O2↑(1分) S+O2SO2 (1分)