2009江苏省金湖中学高考化学模拟试卷
能用到的相对原子质量:H―1 C―12 O―16 Si―28 Cl―35.5 S―32
Mg―24 Al―27 Ca―40
第I卷 选 择 题 (共48分)
一、单选题 本题包括8小题,每小题3分,共计24分。每小题只有一个选项符合题意。
1、化学与生活、环境、社会等密切相关。下列说法正确的是
A.凡含有食品添加剂的食物对人体健康都有害,不可食用
B.棉、丝、毛及合成纤维完全燃烧都只生成H2O和CO2,对环境不会有影响
C.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”和节约资源
D.三聚氰胺(C3H6H6)是引起婴幼儿因食用“三鹿牌”奶粉而患泌尿系统结石病症的元凶,它不属于有机物
2、下列各项中的表达正确的是
A.含1个中子的氦原子为:12He B.四氯化碳的电子式:
C.H2O的路易斯式为:H―O―H D.乙醛的结构简式为:CH3COH
3. 下列关于盐的反应规律的说法中不正确的是
① 盐和酸反应一定生成另一种盐和另一种酸 ② 盐和碱反应一定生成另一种盐和另一种碱 ③ 两种盐反应一定生成另外两种盐 ④ 阳离子相同的两种盐一定不能发生反应
A.只有② B.只有③ C.只有①④ D.①②③④
4. 现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和水;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、蒸馏、萃取 B.萃取、蒸馏、分液
C.分液、萃取、蒸馏 D.蒸馏、萃取、分液
5、设NA表示阿伏加德罗常数,下列说法正确的是
A. 在含有NA个CH3COO-的醋酸溶液中, H+ 数目略大于NA
B. 28g SiO2单质中含有的Si-O键个数为NA
C. 2.9g 熟石膏(2 CaSO4?H2O)含有的结晶水分子数为0.02NA
D. 在标准状况下,2.24L的CCl4中含有C―Cl键的数目约为0.4NA
6、关于工业生产的下列叙述中,不正确的是
A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.工业上用离子交换膜法电解饱和食盐水制烧碱
D.工业上采用电解熔融氯化铝的方法制取金属铝
7、三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱性条件下生成ClO,把二价镍氧化成三价镍。以下说法正确的是
A.可用铁做阳极材料 B.阳极反应方程式为:2Cl-2e-=Cl2↑
C.电解过程中阳极附近溶液的pH升高
D.1 mol二价镍全部转化成三价镍时,外电路中通过了2mol电子
8、下列溶液中的各组离子能大量共存的是
A.pH=2的溶液中:Ca2+、ClO-、Na+、SO32-
B.c(H+)=1.0×10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-
C.由水电离产生的c(H+)=10-13mol/L的溶液中:Fe2+、NH4+、NO3-、Cl-
D.无色透明的溶液中:Cu2+、Na+、SO42-、HCO3-
二、多选题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。)
9、常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.饱和氯水中加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合:
c(Cl-)> c(Na+)>c(Al3+)>c(H+)>c(OH-)
10、有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br―,然后Br+首先与CH2 = CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
A.ClCH2CH2Cl B.BrCH2CH2Br C.BrCH2CH2I D.BrCH2CH2Cl
11、下列各图均为检查装置气密性的方法,根据实验现象判断,其中漏气的是
12、天然油脂结构的核心为甘油(HOCH2CH(OH)CH2OH),有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意:图中的反应式不完整)
下列说法正确的是
A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质
B.该非天然油脂与氢氧化钠溶液共热,其水解产物可与溴水反应
C.非天然油脂为高分子化合物
D.该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物
13、下列反应的离子方程式书写正确的是
A.过量的铁与浓硝酸反应: Fe + 6H++ 3NO3- = Fe3+ 十3NO2↑+ 3H2O
B. 次氯酸钙溶液中通入过量CO2 : ClO-+CO2 + H2O= HClO+ HCO3-
C. 1mol?L-1 的 NaAlO2 溶液和2.5mol? L-1 的盐酸等体积混合:
2AlO2- + 5 H+= Al(OH)3 ↓+ Al3+ + H2 O
D.在碳酸氢镁溶液中加入足量Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-= MgCO3↓ + CaCO3↓ + 2H2O
14、对于平衡体系A(g)+ B(g)=C(g)+ D(g);ΔH<0。下列结论中不正确的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则
+<+
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为∶
C. 若+=+,则往含有 mol气体的平衡体系中再加入mol的B,达到新平衡时,
气体的总物质的量等于2
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
第II卷 非选择题(共72分)
三、非选择题(本题包括6小题,共60分)
15.(10分)
已知几种盐的溶解度随温度变化的曲线如下图所示:
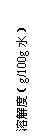 |
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 、趁热过滤、 、干燥。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
16.(8分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
17、(12分)铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第_______周期_______族。
(2)铬元素以Cr2O72-离子的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+离子,再用沉淀法进行分离。已知:Cr3+Cr(OH)3CrO2-
① FeSO4还原Cr2O72-的离子方程式为_____________________________________。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为_____________。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
A.K2Cr2O7是一种常用的强氧化剂 B.NaCrO2溶液与AlCl3溶液混合有沉淀生成
C.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
D.金属铬硬度大、耐腐蚀,是常用的镀层金属
 (3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
说明:1――用蒸馏水浸溶,2――用稀硫酸浸溶,3――冻融后用蒸馏水浸溶,4――曝晒后用蒸馏水浸溶;
3%等――制砖时含铬废渣掺入的比例。
已知我国规定“固体废弃物浸出标准值含铬不得超过10 mg?L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可)
______________________________________________________________________;
______________________________________________________________________。
18、(10分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
③ CO(g)+H2O(g)CO2(g)+H2(g) ΔH3
请回答下列问题:
⑴ 在一密闭容器中进行反应①,测得CH4的物质的
量浓度随反应时间的变化如图1所示。反应进行的
前5 min内, v(H2)= ;10 min时,改变的
外界条件可能是 。
⑵ 如图2所示,在甲、乙两容器中分别充入等物质
的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。
⑶ 反应③中ΔH3= 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO
H2O
CO2
H2
0.5 mol
8.5 mol
2.0 mol
2.0 mol
此时反应③中正、逆反应速率的关系式是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
19、(12分)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,以甲苯为初始原料的合成氯普鲁卡因盐酸盐的路线如下:
回答下列问题:
⑴ 当原料的核磁共振氢谱有 个峰时,可以判断原料是纯净的。
⑶ A的同分异构体中,含有-NO2、-Cl、酯基( ),且为1,3,5-三取代苯结构的有6种,其中4种结构如下:
请写出另外两种同分异构体的结构简式: ▲ 。
⑷ 已知:
①
② 当苯环上已有一个“―CH3”或“―Cl”时,新引入的取代基一般在原有取代基的邻位或对位;当苯环上已有一个“―NO2”或“―COOH”时,新引入的取代基一般在原有取代基的间位。
请用合成反应流程图表示出由甲苯和其他物质合成A的最佳方案,请在答题纸的方框中表示。
合成反应流程图表示方法示例如下:
20.(10分)现代化学工业遵循可持续发展原则,利用淀粉、纤维素等可再生资源合成多种化工产品。
⑴ 以淀粉为原料可制取香料乙酸乙酯,生产流程为:
① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存
在,其中六元环的结构为 ,则葡萄糖在水溶液存在的五元环结构为 ▲ 。
② 若用1000 kg 含(C6H10O5)n 90%的淀粉(杂质不参与反应)为原料制取乙酸乙酯。生产中,淀粉的水解率为90%,乙醇的产率为85%,酯化反应中乙醇、乙酸的转化率均为90%。计算生产中得到的乙酸乙酯的质量(kg)。
⑵ 纤维素的结构可表示为[(C6H7O2)(OH)3]n。10.00 g脱脂棉花(纤维素含量为100%)与乙酸、乙酸酐[(CH3CO)2O]的混合物在一定条件下发生酯化反应,可制得15.19 g醋酸纤维 (纤维素乙酸酯)。请通过计算推断该醋酸纤维的结构简式。
四、选做题(本题包括1小题,共12分)
21.(12分)
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为,具有抗癌作用;反铂的结构式为,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是 ;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式: 。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: 。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
一、单项选择题(本题包括8小题,每题3分,共24分。)
1.C 2.C 3.D 4.A 5.A 6.D 7.B 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.BD 10.A 11.D 12.BD 13.BC 14.D
三、非选择题(本题包括6小题,共60分)
15、(10分)
(1)Fe2+ (1分)
(2)4FeCO3+O22Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、洗涤(2分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(2分)
16.(8分) ⑴Cu、O; ⑵b、c;
⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
⑷a: Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];
b:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
17、(12分)
(1)四 (1分) ⅥB (1分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (1分) ④ ABCD (2分)
(3)① 符合 (1分)
② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;或曝晒对Cr元素浸出影响不明显;
18、(10分)
(1)0.3 mol/(L?min) 升高温度
(2)
(3)-41.2 kJ/mol a
19、(12分)
(1)4
(2) 还原反应
(3)、
(4)
20.(10分)
⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
1000kg×90%×85%×90%×90% m(CH3COOC2H5)
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
10g 15.19g 5.19g
= x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
四、选做题(本题包括1小题,共12分)
21.(12分)
A.⑴ O>N>C 1s22s22p63s23p63d84s2
⑵ 顺铂易溶于水,因为它是极性分子,易溶于极性溶剂
⑶ 4
⑷ ① ② sp3和sp2
 江苏省金湖中学2009届高三化学周练答题纸
江苏省金湖中学2009届高三化学周练答题纸
(本卷满分120分,考试时间100分钟)
第Ⅰ卷
选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
――
――
――
――
非选择题
答题说明:除作图可使用2B铅笔外,其余各题请按题号用0.5mm黑色签字笔书写,否则作答无效。
非选择题(共72分)
15.(10分)
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)化学反应方程式为____________________________。
_________、_________。
(3)产品Ⅱ的化学式为_______________,
操作是: __ 、趁热过滤、 __ 、干燥。
(4) ______
______________________________________________ 。
16.(8分)
(1) ( 填元素符号);
(2) (填代号)。
(3) 、
(不必配平);
(4)a.除去Al3+的离子方程式是 。
b.所选试剂为 。
实验现象为 。
请在各题规定的矩形区域内答题,超出该区域的答案无效!
17.(12分)
(1)第_______周期_______族。
(2)① 离子方程式为_________________________________________________。
② 离子方程式为_________________________________________________。
③ pH应控制在 范围内。
④ 说法中正确的是 。
(3)① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可):
_______________________________________________________________;
_______________________________________________________________。
18. (10分)
(1)v(H2)= 。 改变的外界条件可能是 。
(2)
(3) 。
19. (12分)
(1) 。 (2) ; 。
(3)、 、 。
(4)
请在各题规定的矩形区域内答题,超出该区域的答案无效!
20、(8分)
(1)①五元环结构为 。
②
(2)
四、选做题:
21、(12分)
(1)C、N、O三种元素的电负性由大到小的顺序是 ;
Ni元素基态原子的电子排布式: 。
(2)理由: 。
(3)含有 个铂原子。
(4)① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
请在各题规定的矩形区域内答题,超出该区域的答案无效!