网址:http://m.1010jiajiao.com/timu_id_76877[举报]
一、单项选择题(本题包括8小题,每题3分,共24分。)
1.C 2.C 3.D 4.A 5.A 6.D 7.B 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.BD 10.A 11.D 12.BD 13.BC 14.D
三、非选择题(本题包括6小题,共60分)
15、(10分)
(1)Fe2+ (1分)
(2)4FeCO3+O22Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、洗涤(2分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(2分)
16.(8分) ⑴Cu、O; ⑵b、c;
⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
⑷a: Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];
b:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
17、(12分)
(1)四 (1分) ⅥB (1分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (1分) ④ ABCD (2分)
(3)① 符合 (1分)
② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;或曝晒对Cr元素浸出影响不明显;
18、(10分)
(1)0.3 mol/(L?min) 升高温度
(2)
(3)-41.2 kJ/mol a
19、(12分)
(1)4
(2) 还原反应
(3)、
(4)
20.(10分)
⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
1000kg×90%×85%×90%×90% m(CH3COOC2H5)
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
10g 15.19g 5.19g
= x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
四、选做题(本题包括1小题,共12分)
21.(12分)
A.⑴ O>N>C 1s22s22p63s23p63d84s2
⑵ 顺铂易溶于水,因为它是极性分子,易溶于极性溶剂
⑶ 4
⑷ ① ② sp3和sp2
 江苏省金湖中学2009届高三化学周练答题纸
江苏省金湖中学2009届高三化学周练答题纸
(本卷满分120分,考试时间100分钟)
第Ⅰ卷
选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
――
――
――
――
非选择题
答题说明:除作图可使用2B铅笔外,其余各题请按题号用0.5mm黑色签字笔书写,否则作答无效。
非选择题(共72分)
15.(10分)
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)化学反应方程式为____________________________。
_________、_________。
(3)产品Ⅱ的化学式为_______________,
操作是: __ 、趁热过滤、 __ 、干燥。
(4) ______
______________________________________________ 。
16.(8分)
(1) ( 填元素符号);
(2) (填代号)。
(3) 、
(不必配平);
(4)a.除去Al3+的离子方程式是 。
b.所选试剂为 。
实验现象为 。
请在各题规定的矩形区域内答题,超出该区域的答案无效!
17.(12分)
(1)第_______周期_______族。
(2)① 离子方程式为_________________________________________________。
② 离子方程式为_________________________________________________。
③ pH应控制在 范围内。
④ 说法中正确的是 。
(3)① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可):
_______________________________________________________________;
_______________________________________________________________。
18. (10分)
(1)v(H2)= 。 改变的外界条件可能是 。
(2)
(3) 。
19. (12分)
(1) 。 (2) ; 。
(3)、 、 。
(4)
请在各题规定的矩形区域内答题,超出该区域的答案无效!
20、(8分)
(1)①五元环结构为 。
②
(2)
四、选做题:
21、(12分)
(1)C、N、O三种元素的电负性由大到小的顺序是 ;
Ni元素基态原子的电子排布式: 。
(2)理由: 。
(3)含有 个铂原子。
(4)① 化合物X的结构式为 (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 杂化。
请在各题规定的矩形区域内答题,超出该区域的答案无效!
|
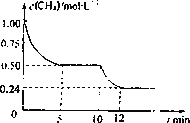
已知:①CO(g)+H2O(g) ②CH4(g)+CO2(g) ③CH4(g)+H2O(g) 若反应③在体积一定的密闭容器中进行,测得CH4的物质的量溶液随反应时间的变化如图所示.下列有关叙述错误的是
| |
| [ ] | |
A. |
ΔH3=+206.1 kJ/mol |
B. |
反应③进行到10 min时,改变的外界条件可能是升高温度 |
C. |
反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
D. |
当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
|
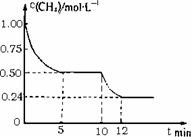
已知:①CO(g)+H2O(g) ②CH4(g)+CO2(g) ③CH4(g)+H2O(g) 若反应③在1L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示.下列有关叙述错误的是
| |
| [ ] | |
A. |
ΔH3=+206.1 kJ·mol-1 |
B. |
反应③进行到10 min时,改变的外界条件可能是升高温度 |
C. |
反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
D. |
当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。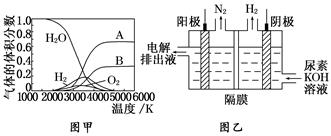
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为_____________________________________
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。
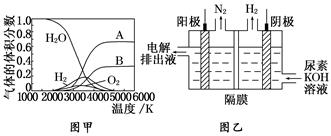
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为_____________________________________
 CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol②CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH3
CO(g)+3H2(g) ΔH3若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
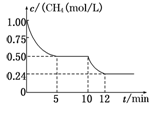
| A.ΔH3=+206.1 kJ/mol |
| B.反应③进行到10 min时,改变的外界条件可能是升高温度 |
| C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
| D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |