2009年广东省佛山市高中阶段学校招生考试
化学试卷
本试卷分选择题和非选择题两部分,共8页,满分100分。考试时间90分钟。
可能用到的相对原子质量:H
第Ⅰ卷(选择题 共30分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列物质属于碱的是
A.CO2 B.HCl C.NH3?H2O D.K2SO4
2.下列属于化学变化的是
A.研碎胆矾 B.铜表面产生铜绿 C.过滤 D.制取蒸馏水
3.下列不属于使用新燃料或开发新能源的事实是
A.禁止超市为顾客无偿提供塑料袋 B.开发大西北的“西气东输”工程
C.鼓励使用太阳能电池 D.推广使用车用乙醇汽油
4.下列实验设计与对应的实验目的表述不一致的是
A.比较火焰 B.检验氢气的纯度 C.验证CO2的密度 D.探究空气的组成
各层温度 比空气大 成分
5.我国曾发生过多次将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件。下列有关NaNO2的说法正确的是
A.NaNO2是一种氧化物
B.NaNO2由三种元素组成
C.NaNO2中氮元素的化合价为-3价
D.NaNO2中Na、N、O三种元素的质量比为1∶1∶2
A.
B.
C.
D.
实验现象

用扫描隧道显微镜获得的苯分子的图像
品红加入水中后,整个液体变红色

分子在不同温度下的运动情况

50mL水与50mL酒精混合后的体积小于100mL
解释
分子的质量和体积都很小
分子总是在不断运动着
常温时分子不运动,加热时分子才运动
分子间有间隙
6.对下列实验现象进行的解释错误的是
7.常见金属的活动性顺序如下:

根据金属活动性顺序进行分析,下列描述或判断错误的是
A.常温下,金属镁在空气中要比铁容易氧化
B.在氧气中灼烧时,铁丝要比铜丝反应剧烈
C.在同一盐酸中反应时,锌片比铁片反应剧烈
D.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银
8.“归纳与比较”是化学学习的重要方法,下列有关CO2与CO的知识归纳错误的是
A.
组成
1个二氧化碳分子比1个一氧化碳分子多1个氧原子。
B.
性质
都是无色无味的气体;都能溶于水,水溶液显酸性;都能与碱反应;都能燃烧等。
C.
用途
CO2可用于光合作用、灭火、化工产品的原料和气体肥料,“干冰”可用于人工降雨等;CO可用作气体燃料、冶炼金属的还原剂等。
D.
危害
CO2会造成“温室效应”;CO极易与血液中的血红蛋白结合引起中毒等。
9.最近,不少媒体报道,某些凉茶原料中有一味中药材叫夏枯草,长期饮用可能患胃溃疡等疾病。胃溃疡是由于胃酸和胃蛋白酶对粘膜自身消化所形成的。下列可用于治疗胃酸过多的药剂有
①NaOH ②Na2CO3 ③NaHCO3 ④肥皂水 ⑤Al(OH)3
A.①③ B.②④ C.①⑤ D.③⑤
10.下图是某服装标签的部分内容,下列有关认识错误的是

A.里料是由一种材料制成的
B.涤纶属于有机高分子材料
C.涤纶属于天然纤维
D.可通过灼烧来区别涤纶和羊毛
11.在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见下图。下列有关认识错误的是
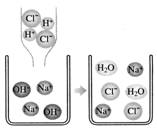
A.反应结束时溶液的pH=7
B.反应前后元素的种类没有变化
C.酸与碱的反应属于复分解反应
D.该微观图还可说明所有物质都是由分子构成的
12.下列物质能共存于同一溶液中,且无色透明的是
A.NaOH、NaNO3、K2SO4 B.CuSO4、MgSO4、KCl
C.Ba(OH)2、H2SO4、NaCl D.NaCl、AgNO3、HNO3
13.金属R与硫酸铜溶液反应的化学方程式是R+CuSO4=Cu+RSO4,下列说法正确的是
A.该反应属于复分解反应 B.金属R的活泼性比Cu要强
C.该金属可以是金属铝 D.该金属一定是铁
14.用纯净的木炭粉末还原氧化铜粉末时,可发生的反应有:C + 2CuO 2Cu + CO2↑,
2Cu + CO2↑,
C + CuO Cu + CO↑。现用
Cu + CO↑。现用
A.CO2 B.CO C.CO、CO2 D.Cu、CO
15.在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用下图曲线表示的是
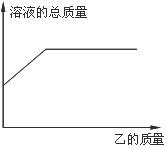
A.①② B.③④ C.①⑤ D.②⑤
第Ⅱ卷(非选择题 共70分)
二、(本题包括5小题,共22分)
16.(6分)化学上常用化学式来表示物质,以下是一些常见物质的化学式:
①Fe2O3 ②NH4Cl ③NaCl ④CH4 ⑤CaCO3 ⑥H2O2
请按要求填空(每空只选填一个编号):
(1)用于配制生理盐水的物质 ; (2)天然气的主要成分 ;
(3)实验室用来制氧气的物质 ; (4)赤铁矿的主要成分 ;
(5)农业上可用作化肥的物质 ; (6)大理石的主要成分 。
17.(5分)下图是锂原子的构成示意图,根据图示信息回答下列问题:

(1)锂元素的原子序数为 ,元素符号为 。
(2)锂原子的结构示意图为 (填字母)。
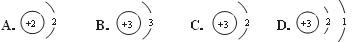
(3)锂元素与氧元素形成的化合物的化学式为 。
(4)下列对原子构成的理解错误的是 (填字母)。
A.原子整体不显电性 B.原子核比原子小得多
C.原子核是不可分割的实心球体 D.原子质量主要集中在原子核上
18.(4分)3月底以来,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感),这是一类由病毒引起的流感。对周围环境采取严格的消毒措施,是预防H1N1型流感的重要方法。下面是自来水消毒过程中发生反应的微观图,产物之一是次氯酸(HClO),具有杀菌消毒作用。
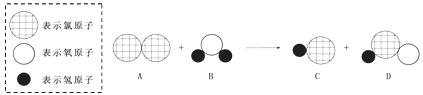
(1)该反应的化学方程式为 。
(2)可通过检验产物C来证明该反应已发生,方法是在反应后的溶液里滴几滴AgNO3溶液,有白色沉淀生成。用化学方程式表示其原理 。
19.(4分)查阅资料知道,鸡蛋壳的主要成分是碳酸钙。某同学为了验证鸡蛋壳的主要成分是碳酸钙,设计了下图的实验。
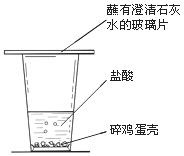
(1)实验过程中看到的现象是 。
(2)小明认为该实验方案不完整,还需验证鸡蛋壳的主要成分属于钙盐,方法是取反应后的上层清液加入 (填字母)。
A.Na2CO3溶液 B.AgNO3溶液
C.NaCl溶液 D.Ca(OH)2溶液
(3)鸡蛋壳与盐酸反应的化学方程式为 。
20.(3分)下表是3种物质在不同温度时的溶解度,根据表格信息答题。
温度/℃
0
20
40
60
80
100
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
KNO3
13.3
31.6
63.9
110
169
246
Ca(OH)2
0.18
0.16
0.14
0.12
0.09
0.07
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式)。
(2)要配制
(3)某KNO3晶体中有少量NaCl、Ca(OH)2杂质,要得到纯净KNO3的方法是:先加热溶解,然后 ,过滤、洗涤、干燥后得到KNO3晶体。
三、(本题包括4小题,共21分)
21.(5分)三聚氰胺的化学式为C3H6N6(结构见下图),是一种用途广泛的有机化工原料。该物质为纯白色晶体,无味,溶于热水,微溶于冷水。一般情况下较稳定,但在高温下能分解放出氰化物。
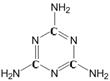
(1)三聚氰胺的相对分子质量为 ,化学性质有 (写一条)。
(2)根据三聚氰胺的组成和结构进行分析,下列有关有机物的认识错误的是
(填字母)。
A.有机物都含有碳元素
B.有机物还可能含有氢、氮等元素
C.有机物中碳原子可以跟氢、氮等原子直接结合
D.有机物的相对分子质量都很大,都属于有机高分子
(3)通常可用尿素[CO(NH2)2]在一定条件下反应生成三聚氰胺,同时放出氨气和二氧化碳气体,请写出反应的化学方程式 。
22.(5分)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:

(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
。
23.(5分)在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
【实验目的】铁生锈条件的探究。
【实验内容】取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
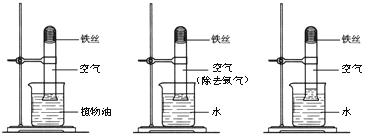
实验① 实验② 实验③
【实验现象】实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。
【实验结论】铁生锈实际上是铁与空气中的 (填名称)发生反应的结果。
【实验思考】
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和 两种现象来判断铁丝反应进行的情况。
(3)用完的菜刀要擦干存放,理由是 。
(4)铝比铁活泼,但铝难腐蚀,原因是 。24.(6分)A、D均为黑色固体(D为常见金属),B为胃酸的主要成分,C为蓝色溶液,D、E、F均为单质。下图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略。
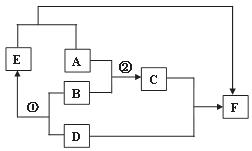
(1)请写出下列物质的化学式: E ,F 。
(2)反应①除了生成E,另一生成物的化学式为 ,该反应的基本类型是 。
(3)写出反应②的化学方程式 。
四、(本题包括2小题,共17分)
25.(10分)某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
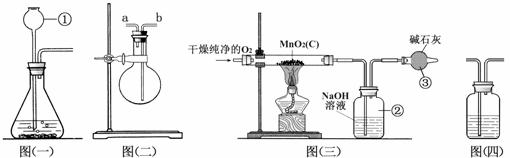
(1)仪器①的名称是 。如果该实验选择图㈠装置来制取氧气,则所用药品为 (填化学式),反应的化学方程式为 。
(2)用图㈡装置可收集和干燥氧气:若烧瓶充满水来收集氧气,气体应从 (填“a”或“b”,下同)端通入;若在烧瓶内装入浓硫酸进行干燥气体,气体应从 端通入。
(3)图㈢是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有碱石灰,其作用是____________________________________________________。
(4)为验证图㈢中装置②已将CO2吸收完全,可在装置②与③之间加入图㈣装置进行证明,则图㈣装置中加入的试剂为__________(填字母)。
A.NaOH溶液 B.澄清石灰水 C.浓硫酸
(5)称取
26.(7分)已知某合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究。
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应。
【猜 想】猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有 (填名称)。
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
实验方案
实现现象
结论
①取一定量的合金粉末,加过量的
,充分反应后过滤,滤渣备用。
粉末部分溶解,并有气体放出。
合金中一定含有 。
②取步骤①所得滤渣,加过量的
,充分反应。
滤渣部分溶解,并有气体放出,溶液呈浅绿色。
合金中一定含有 。
【探究结论】猜想3成立。
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式 。
五、(本题包括2小题,共10分)
27.(3分)生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷的混合气体。该气体中的甲烷(CH4)可用来还原CuO粉末得到金属铜,化学反应的方程式为:CH4+4CuO CO2+2 +4Cu。
CO2+2 +4Cu。
(1)上述化学反应方程式中“ ”内对应产物的化学式为 。
(2)铜元素在化学反应前后化合价变化情况是:从 价变到 价。
(3)甲烷中碳元素的质量分数为 (填计算结果)。
28.(7分)烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为
加入NaOH溶液的质量/g
50.0
100.0
150.0
200.0
250.0
生成沉淀的质量/g
0.0
2.5
8.6
9.8
9.8
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线(见答题卡)。