2009年辽宁中考综合复习训练化学试题(七)
理化考试时间l50分钟 化学试卷满分65分
可用到的相对原子质量:H―1 O―16 S―32 Cu―64
一、选择题(本题包括l3道小题,l―11小题每小题1分;l2、13小题每小题2分;共15分。每小题有一个最符合题目要求的选项。请选出后将其序号填在题后的括号内)
1.铁丝在空气中灼烧发红,但不能燃烧.这一事实与下列哪一因素关系密切 ( )
A.铁丝的表面积 B.氧气的浓度 C.燃烧区的温度 D.铁的着火点
2.某同学在研究物质燃烧的条件时,做了如图所示的实验:把一条粗金属绕成线圈,罩在一支蜡烛的火焰上,火焰很快就熄灭了。对这一实验的说法正确的是 ( )
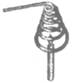
A.金属丝有良好的导电性
B.金属线圈内的气体温度升高了
C.降低可燃物着火点
D.若预先将金属丝加热,蜡烛就不会很快熄灭
3.常温下某同学测得一些食物的近似pH,显碱性的是 ( )
A.桃子3.5 B.苹果汁:3.
4.为防止骨质疏松,应补充的元素是 ( )
A.铁 B.锌 C.钙 D.碳
5.决定元素种类的是 ( )
A.质子数 B.中子数 C.电子数 D.最外层电子数
6.在日常生活中,不作调味品的物质是 ( )
A.食盐 B.蔗糖 C.白醋 D.自来水
7.下列物质中,不需密封保存的是 ( )
A.浓硫酸 B.氢氧化钠 C.大理石 D.澄清石灰水
8.钒(V)被誉为金属中的“维生素”,其氧化物V2O5中钒元素的化合价是 ( )
A.+1 B.+
9.汽车安全气囊内的物质能在碰撞后10 S内迅速反应,生成一种空气中含量最多的气体,该气体是 ( )

A.氧气 B.二氧化碳 C.氮气 D.稀有气体
10.氯元素的原子结构示意图为 ,下列说法中,错误的是 ( )
,下列说法中,错误的是 ( )
A.氯原子带有7个单位的负电荷
B.氯原子在化学反应中容易得1个电子
C.氯原子核外有3个电子层
D.氯原子的核电荷数为17
11.为确保生命安全,处理事故的正确方法是 ( )
A.进入溶洞,燃着的火把熄灭后继续前行
B.厨房内管道煤气(主要成分为CO)泄漏,应马上点火燃尽
C.桌面上酒精灯内酒精洒出,着火燃烧,立即用湿抹布扑灭
D.炒菜时油锅着火,立刻浇水灭火
12.欲除去下列物质中混有的少量杂质,其所选用的试剂和方法均正确的是 ( )
选项
物质
杂质
试剂和方法
A
氧化铁
铁
盐酸:过滤
B
氢氧化钠溶液
碳酸钠
适量澄清石灰水:过滤
C
氯化钠溶液
碳酸钠
足量盐酸:过滤
D
一氧化碳
二氧化碳
水:洗气
13.有一包白色同体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示。由此推断白色固体中 ( )
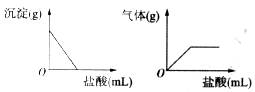
A.可能存在NaOH B.可能存在Na2SO4
C.肯定不存在BaCl2 D.肯定只存在Na2CO3
二、填空题(本题包括4道小题,每空l分,共14分)
14.黑火药是我国古代四大发明之一。黑火药的主要原料是木炭、硝石和硫磺,黑火药燃烧发生反应的化学方程式为S+2KNO3+ X+N2↑+3CO2↑,则X的化学式为____________________________。
X+N2↑+3CO2↑,则X的化学式为____________________________。
15.KCl是常用的化肥。下图是KCl的溶解度曲线。请回答:
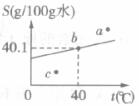
(1) 、b、c三点中溶液处于不饱和状态的是__________点。
、b、c三点中溶液处于不饱和状态的是__________点。
(2)
16.
(1)北京奥运场馆备受世人瞩目。下列介绍的材料中,属于有机合成材料的是______ (填字母,下同);

(北京)奥运会期间供应的重点菜肴之一是北京烤鸭。食用烤鸭时配以薄饼、大葱、甜面酱和黄瓜等,营养丰富,其中含有的营养素有油脂、糖类、_____________、水、维生素和无机盐等:
(3)北京奥运村的生活热水都由太阳能热水利用系统提供。下列有关太阳能的说法中,正确的是___________________;

A.取之不尽 B.是化石燃料
C.是无污染能源 D.可转变为热能、电能
(4)北京奥运“祥云”火炬上端的外壁有430个通气孔。这些孔不仅能把燃烧的废气排出去,还能_______________________,以保证燃料的充分燃烧;
(5)北京奥运“蓝天计划”重在改善北京的空气质量。市政府采取的有效措施之一是冬季用燃烧天然气代替燃煤取暖,该项措施的作用是_________________________;
(6)北京奥运会游泳馆“水立方”外墙材料的生产原料之一是四氟乙烯(C
17.
(1)地球表面约有71%被水覆盖,但可供人类使用的淡水总量却不足总水量的1%。保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法会造成水体污染的有_________________(填序号)。
A.工业废水直接排放 B.工业废水处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
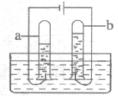
(2)下图是通电分解水的实验装置。在实验过程中,试管a中产生的气体是______;
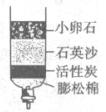
(3)为除去水中的不溶性杂质,某同学制作了如下图所示的简易净水器,其中活性炭的主要作用是______________________________________________________;
(4)自来水中含有少量的Ca(HCO3)2等可溶性盐。烧水时,Ca(HCO3)2发生分解反应,生成难溶性的CaCO3是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式:______________________________________________________________________。
三、简答题(本题包括4道小题,共22分)
18.(4分)下图所示是家庭中常用的几种灭火方法,请将相应方法的灭火原理填在表中对应的空白处。

19.(5分)某课外活动小组的同学利用下列装置探究CO2的实验室制法。
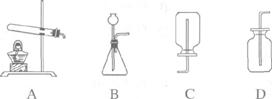
(1)甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是_________,收集装置是_____________。发生反应的化学方程式为_____________________________;
(2)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
NH4HCO3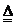 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是_____________,他不选择加热碳酸氢铵制取CO2的理由是_______________________________________。
20.(6分)某同学在自主学习酸的知识时,设计了以下实验报告,请将该实验报告补充完整。
【实验目的】_______________________________________________________________。
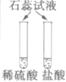
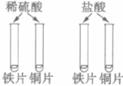
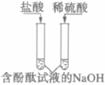
【实验用品】试管、铁片、铜片、稀盐酸、稀H2SO4、NaOH溶液、石蕊和酚酞试液等。
【实验内容】
实验步骤
(1) 
(2)
(3) 
实验现象
溶液变为________色
稀硫酸中的Fe片表面都有________产生,Cu片表面都没有明显现象
溶液由红色变为无色
分析与
结论
结论:稀酸能与指示剂作用
铁与稀硫酸反应的化学方程式为_____________________________
结论:稀酸能与较活泼金属反应
结论:
酸能_______________
【实验思考】从物质组成的角度解释酸具有通性的原因__________________________。
21.(7分)某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品。
(一)原料岩盐水主要是含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁。上述几种物质在不同温度时的溶解度数据如下表:
温度/℃
0
10
20
30
40
溶
解
度
/g
氯化钠
35.7
35 8
36.0
36.3
36.6
硫酸钠
4.5
9.6
20.2
40.8
48.4
氯化钙
59.5
65.0
74.5
100
116
氯化镁
52.9
53.8
54.8
56.0
58.0
(1)根据所提供的溶解度数据,画出硫酸钠的溶解度曲线:
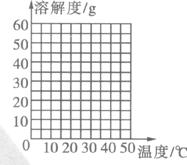
(1)
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
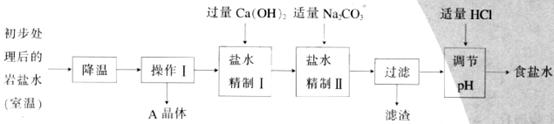
(3)“降温”的目的是析出副产品“A晶体”,A的化学式是______________;
(4) “操作I”中的操作是_____________,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有_______________________________;
(5) “盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是:
__________________________________________________________________________;
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是:
_________________________________________________________________________。
四、探究题(本题包括l道小题,共8分)
22.(8分)实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液。

(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、
Ca(OH)2、NaOH和稀盐酸,其中有颜色的是_______________________溶液。
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸。
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液可能是Na2CO3、NaCl、Ca(OH)2和稀盐酸。
(3)实验探究:同学们按以下步骤进行鉴别。
第一步:取4支试管,分别加入少量的A、B、C、D溶液。然后依次加入少量盐酸,实验现象记录如下:
溶液
A
B
C
D
加入盐酸后的现象
无明显变化
无明显变化
有气泡产生
无明显变化
实验结论:C是___________溶液。
第二步:依据下图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化。
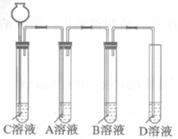
实验解释:A溶液中发生反应的化学方程式为___________________________。
第三步:依据下图装置进行2个实验。取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热。

实验结论:B是稀盐酸。D是NaCl溶液.
经过上述三步实验.同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程,进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是_____________溶液:其鉴别方法是____________________________________________________________________________
_____________________________________________________________________________。
②老师提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液。请完成下列实验报告。
实验步骤
实验现象和结论
五、计算题(本题包括l道小题,共6分)
23.(6分)将铜和氧化铜固体混合物粉末
(1)混合物中铜元素的质量分数为______________(计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数,写出计算过程。