摘要:(3)“降温 的目的是析出副产品“A晶体 .A的化学式是 , (4) “操作I 中的操作是 .若在实验室进行该操作.需要用到的玻璃仪器除烧杯.玻璃棒外.还有 , (5) “盐水精制I 是除去盐水中的少量氯化镁.反应的化学方程式是: ,(6)“盐水精制Ⅱ 是除去盐水中的其他杂质.反应的化学方程式是: .
网址:http://m.1010jiajiao.com/timu_id_914053[举报]
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是
(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_
(3)“操作I”名称是 _
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:
(三)工业纯碱中杂质的判断:已知:NH4Cl
NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质
查看习题详情和答案>>
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
8.8%
8.8%
(精确到0.1%).(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_
Na2SO4
Na2SO4
;(3)“操作I”名称是 _
过滤
过滤
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
、CaCl2+Na2CO3═CaCO3↓+2NaCl
CaCl2+Na2CO3═CaCO3↓+2NaCl
(三)工业纯碱中杂质的判断:已知:NH4Cl
| ||
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质
NaCl
NaCl
(写化学式)某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺
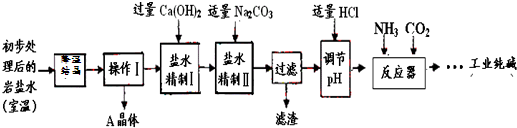
经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_________;
(3)“操作I”名称是 _________
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:________、________
(三)工业纯碱中杂质的判断:已知:NH4Cl
 NH3↑+HCl↑
NH3↑+HCl↑实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质________(写化学式) 查看习题详情和答案>>
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是______(精确到0.1%).
(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_______;
(3)“操作I”名称是 _______
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:______、______
(三)工业纯碱中杂质的判断:已知:NH4Cl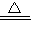 NH3↑+HCl↑
NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质______(写化学式)
查看习题详情和答案>>
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | ||
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_______;
(3)“操作I”名称是 _______
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:______、______
(三)工业纯碱中杂质的判断:已知:NH4Cl
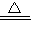 NH3↑+HCl↑
NH3↑+HCl↑实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质______(写化学式)
查看习题详情和答案>>
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是 (精确到0.1%).
(二)生产工艺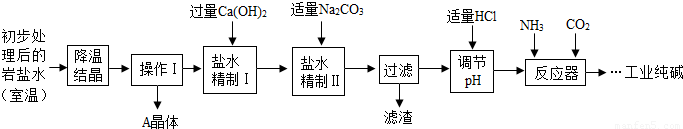
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是 ;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是 ,可重复利用的是 (水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是 .
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
(四)含量测定
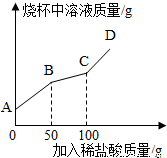
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量 .
(7)请通过计算并结合表判断此纯碱样品等级为 品.
 查看习题详情和答案>>
查看习题详情和答案>>
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | ||
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

(2)“降温”的目的是析出副产品“A晶体”,A的化学式是 ;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是 ,可重复利用的是 (水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是 .
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
(四)含量测定
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量 .
(7)请通过计算并结合表判断此纯碱样品等级为 品.
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
 查看习题详情和答案>>
查看习题详情和答案>>
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
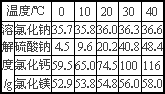
(1)根据所提供的溶解度数据,画出硫酸钠的溶解度曲线.
(2)10℃时由100 g水配制得到的饱和硫酸钠溶液中溶质的质量是________g,溶质的质量分数是________(精确到0.1%).
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
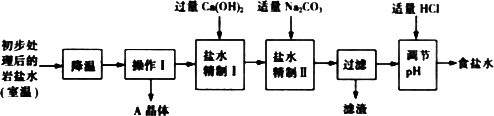
(3)“降温”的目的是析出副产品“A晶体”,A的化学式是________.
(4)“操作I”中的操作是________,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有________.
(5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是________.
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是________.