2008-2009学年度聊城市临清第一学期九年级期中考试
化学试卷
相对原子质量:H―
第Ⅰ卷(选择题 共40分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.下列日常生活中常发生的变化,其中均属于化学变化的一组是
A.湿衣服晾干 酒精燃烧 B.汽油挥发 动植物的呼吸
C.剩饭变馒 铁锅生锈 D.灯泡通电发热发光 西瓜榨成汁
2.某种金属工艺品有银白色的金属光泽,同学们认为它可能和铁一样有磁性。在讨论时,有同学提出“我们可以先拿磁铁来吸一下”。就“拿磁铁来吸一下”这一过程而言,属于科学探究中的
A.提出问题 B.实验 C.假设 D.做出结论
3.下列事实与化学有关的是
①开发新能源 ②使天变得更蓝 ③研究资源再利用 ④研制新药物 ⑤研制高效且对人毒性小的农药
A.①④⑤ B.①③④ C.①②④⑤ D.①②③④⑤
4.分子与原子的根本区别在于
A.化学反应中是否可分 B.是不是构成物质的微粒
C.大小不同 D.质量不同
5.为改善北京市的生态环境,迎接2008年奥运会,北京市把治理大气污染和水资源保护作为重中之重,下列各项措施:①控制工业废水和生活污水的直接排放;②完成燃煤锅炉的改造,改用清洁燃料;③植树、种草、增大绿化面积;④公交车改用清洁燃料。可以减少大气、水污染的措施有
A.①② B.②④ C.①②④ D.①②③④
6.下列物质在氧气中燃烧,产物为白色固体的是
A.镁 B.硫 C.木炭 D.铁
7.下列性质属于纸的化学性质的是
A.白色 B.不溶于水 C.易撕碎 D.可燃
8.区别氧气、氮气、空气最简单的方法是
A.用带火星的木条 B.用燃着的木条
C.用燃着的硫粉 D.用澄清石灰水
9.能证明分子在化学反应中可以再分的实验事实是
A.玻璃粉碎 B.用自来水制蒸馏水
C.分离液态空气得到氧气和氮气 D.电解水得到氧气和氢气
10.原子失去或得到电子后,一定不会引起改变的是
①核外电子数 ②原子核 ③化学性质 ④相对原子质量 ⑤粒子的电性
A.③④ B.②③ C.②④ D.②③④⑤
11.在溶解和配制溶液时,下列仪器中需选用的是
A.集气瓶 B.烧杯 C.蒸发皿 D.漏斗
12.下列有关实验操作正确的是
A.给试管中的固体加热时,试管口要略低于试管底
B.用剩的药品不要乱丢,要收回原试剂瓶内
C.在熄灭酒精灯时,应用嘴吹灭
D.给试管中的液体加热时,可面对着试管口进行观察
13.下列各组物质中,前一种是单质,后一种是化合物的是
A.水、氧化镁 B.氢气、澄清石灰水
C.红磷、二氧化碳 D.冰、过氧化氢
14.下列有关物质的性质及相关用途的叙述,正确的是
①氧气易溶于水,使得鱼能在水中生存 ②氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 ③氧气能支持燃烧,所以可用作火箭的高能燃料 ④由于稀有气体有惰性,所以常用作保护气
A.①②③ B.①②④ C.①③ D.②④
15.下列反应中属于分解反应的是
A.氢气+氧气 水 B.水
水 B.水 氧气+氢气
氧气+氢气
C.水+二氧化碳→碳酸 D.氢气+氧化铜 铜+水
铜+水
16.以下保存和取用药品的方法不合理的是
A.块状固体石灰石存放在广口瓶中 B.稀盐酸存放在细口瓶里
C.用滴管取用大量液体 D.用药匙取用碳酸钠粉末
17.下列叙述错误的是
A.分子、原子和离子都直接构成物质
B.决定原子质量大小的主要是质子和电子
C.原子中原子核与核外电子的电量相等,电性相反,因而原子不显电性
D.原子如果得到或失去电子就变成了离子
18.做空气中氧气含量测定的实验装置如下图。下列有关说法正确的是
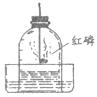
A.选用红磷是因为反应可以耗尽O2,生成固态的P2O5
B.燃烧匙中的红磷可以换成硫或木炭
C.燃烧匙中的红磷越多,水位上升越高
D.本实验可以证明空气中含有N2、O2、CO2和稀有气体
19.化学概念在逻辑上存在如下图所示的关系,下列概念间的关系,说法正确的是

A.纯净物与混合物属于包含关系
B.单质与化合物属于交叉关系
C.化合物与氧化物属于包含关系
D.氧化反应与化合反应属于并列关系
20.2008年9月发生了轰动全国的三鹿牌婴幼儿奶粉中毒事件,原因是其中加入的三聚氰胺(其化学式为C3H5N6)严重超标,三聚氰胺如果长期或大量摄入对肾与膀胱产生影响,导致产生结石。下列关于三聚氰胺的说法正确的是
A.三聚氰胺是由三个碳元素、六个氢元素和六个氮元素组成
B.三聚氰胺是由三个碳原子、六个氢原子和六个氮原子构成
C.三聚氰胺的相对分子质量为
D.三聚氰胺是由碳元素、氢元素和氮元素组成
第Ⅱ卷(非选择题 共60分)
三、填空与简答题(本题包括6小题,共25分)
21.(4分)利用“物理性质”、“化学性质”、“物理变化”、“化学变化”等名词填空:
(1)水冷却到
(2)煤燃成了灰烬,为_____________。
(3)镁条能在空气中燃烧,为_______________。
(4)镁条呈现固态、银白色,为_____________。
22.(3分)分离混合物常用的方法有:①过滤;②蒸发;③蒸馏。选择合理的方法分离下列混合物(填序号)。
A.食盐和沙__________;B.酒精和水_________;C.从海水中获取食盐_______。
23.(3分)请你各举一实例说明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的,实例:________________不是无色的;
(3)溶液中的溶质一定是固体,实例:________________可做溶质,但不是固体。
(2)均一、稳定的液体都是溶液,实例:______________是液体但不是溶液;
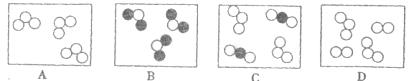
24.(2分)已知“○”、“●”表示质子数不同的原子。下图中表示的气体物质中,属于化合物的是___________,属于混合物的是_____________。
25.(3分)根据二氧化碳的化学式CO2,你能获得哪些信息?
(1)___________________________________________________;
(2)___________________________________________________;
(3)___________________________________________________。
26.(10分)用“化学式关系式”表示下列化学反应
例如:磷在氧气中燃烧可表示为:P + O2 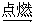 P2O5
P2O5
(磷) (氧气) (五氧化二磷)
(1)木炭在氧气中燃烧;
(2)电解水生成氢气和氧气
(3)甲烷(CH4)燃烧生成二氧化碳和水
(4)实验室用双氧水制取氧气
(5)铜跟空气中的氧气在加热条件下反应生成氧化铜(CuO)
四、实验探究题(本题包括2小题,共15分)
27.(6分)“化学反应条件的控制是实验灵魂”。某校化学兴趣小组在老师指导下,进行了“影响双氧水分解因素”的实验,请你帮助回答下列问题。
(1)向倒入适量15%双氧水的大试管中加入适量的MnO2,再用排水集气法收集一小试管气体。该操作过程中合理的排列顺序是_____________(选填序号)
①检验装置的气密性 ②待有连续稳定气泡再排水集气 ③将水槽中待收集气体的小试管注满水 ④旋紧连有导管的单孔胶塞 ⑤向大试管内倒入适量双氧水再加入少许MnO2粉末
(2)实验室中收集氧气的方法有多种,下图所示的集气方法中正确的有__________;
现有下图一种变式收集氧气的方法,你认为进气应在_______端(填“a”或“b”)。
(3)取a、b两支试管加入等体积6%的双氧水,再分别加入少许MnO2粉末、CuO粉末,发现a中比b中产生气泡多且快。随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃,由此得出影响双氧水分解的因素是________。
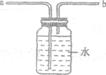
(4)再取一支试管倒入适量6%的双氧水,仔细观察溶液内有少量细小气泡浮起;然后将该支试管浸入约
(5)每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下表,分析表中数据,H2O2溶液的溶质质量分数是怎样影响反应速率的?
__________________________________________________________________________。
实验次序
1
2
3
4
5
6
7
8
H2O2溶液溶质质量分数
1%
3%
5%
10%
15%
20%
25%
30%
MnO2粉末用量/g
0.2
0.2
0.2
0.2
0.2
0.2
0.2
0.2
收集到540mL气体时所用时间/s
660
220
205
80
25
9
4
3
28.(9分)某兴趣小组对人体吸入的空气和呼出的气体的探究可以分四步进行:
步骤一:取样。即取两瓶人体呼出的气体和两瓶空气。
获取一塑料瓶空气的方法是__________________________________________________,获取空气的其他方法还有____________________________________。
步骤:探究。①向呼出的气体和空气中各滴入澄清的石灰水,振荡,现象是_________
________________________________,结论是_________________________________。你认为该实验方案______(填“能”或“不能”)得出准确的实验结果。
②把燃着的木条分别插入呼出的气体和空气中,现象是__________________________
__________________,结论是___________________________________。
③向干燥的玻璃片上呼气,与没有呼气的玻璃片对比,现象是_____________________
_____________,结论是_____________________________________________________。
五、计算题(本题包括2小题,共17分)
29.(7分)要配制
配制方案
(只说明配制时所需的各种药品及用量)
方案一
方案二
方案三

(1)维生素D种类较多,其中维生素D3的化学式为C27H44O,则维生素D3中碳、氢、氧元素的质量比;
(2)碳酸钙(CaCO3)中钙元素的质量分数;
(3)该“超人”高钙片中碳酸钙的质量分数。