2007年扬州市化学中考试卷
可能用到的相对原子质量:H―1 C―12 O―16 N―l4 Na―23 S―32 C1―35.5
Fe―56 Cu―64 Ag―108
第Ⅰ卷(选择题 共40分)
一、选择题(本题包括15小题,每小题分,共30分。每小题只有一个选项符合题意。)
1.央视经济频道“CCTV倾国倾城”中国名城全球网络推介活动正在进行中,2006年获“联合国最佳人居奖”的扬州已升至第三名。下列做法对保护古城环境无益的是 ( )
A.大力提倡市民使用小汽车,提高生活质量
B.加强工业用水系统的环保改造,提高水的重复利用率
C.研究开发“绿色化学”工艺,使原料完全转化为产物
D.推广垃圾的分类存放、回放、处理
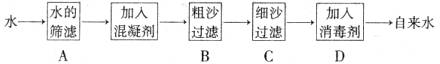
2.下图为自来水生产的一种流程示意图,其中属于化学变化的步骤是 ( )
3.图示材料属于合金的是 ( )

4.美国火星探测车在火星大气层中检测到COS气体。该物质属于 ( )
A.单质 B.酸 C.化合物 D.氧化物
5.英国伦敦大学的科学家发明一种“智能玻璃”――不用空调,冬暖夏凉。秘密在于其表面的超薄层物质二氧化矾(VO2)和钨(W)的混合物。VO2中V的化合价为 ( )
A.+l B.+2 C.+3 D.+4
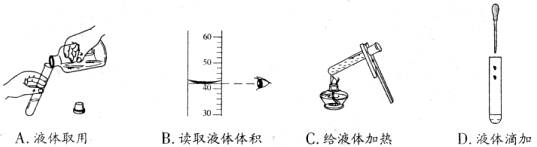
6.下列实验操作错误的是 ( )
7.发展离不开能源。下列说法错误的是 ( )
A.煤、石油和天然气是三种重要的化石燃料
B.煤是“工业的粮食”,石油是“工业的血液”
C.“西气东输”工程让扬州居民用上天然气,对改善扬州环境有益
D.天然气、石油、氢能、生物质能是迫切需要人们开发的新能源
8.1967年,N.H.Willians将微波技术引入化学。后来吉林大学某研究小组利用该技术处理废中的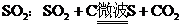 ,则该反应是 ( )
,则该反应是 ( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
9.营养学上依据食品在人体中代谢产物的酸碱性,一般将食品分成酸性食品和碱性食品。其中显碱性的酸性食品是 ( )
A
B
C
D
食品
鸡蛋清
葡萄
苹果
草莓
食品类别
酸性食品
碱性食品
碱性食品
酸性食品
pH
7.6~8.0
3.5~4.5
2.9~3.3
3.0~3.5
10.高铁酸钾是一种新型高效、绿色环保的净水剂,湿法合成的方程式为:2Fe(OH)3 +3KClO+4KOH==2X(高铁酸钾)+3KCl+5H2O,则X的化学式为 ( )
A.K4FeO4 B.K2FeO6 C.K2FeO4 D.K2Fe2O4
11.如图是气体X的干燥、收集、尾气吸收装置,该气体可能的物理性质是 ( )

A.密度比空气大,极易溶于水 B.密度比空气小,极易溶于水
C.密度比空气大,难溶于水 D.密度比空气小,难溶于水
12.科学饮食是健康的保证。下列说法错误的是 ( )
A.糖尿病人应控制食用蔗糖、淀粉等糖类食品
B.误食重金属盐,可服牛奶或鸡蛋清解毒
C.油脂、淀粉是膳食的重要组成部分,它们的组成元素不同
D.维生素摄入量不足会患营养缺乏症
13.下列生产生活中的说法合理的是 ( )
A.用温热的食醋浸泡清洗热水瓶中的水垢
B.用CuSO4溶液和烧碱配制波尔多液
C.用燃着的火柴检验煤气是否泄漏
D.使用化学肥料见效快,对土壤结构无任何破坏
14.下列气体能用如图装置制取,并能实现“随开随用、随关随停”的是 ( )
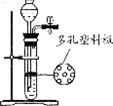
A.碳酸钠和稀硫酸制取二氧化碳 B.锌粉和稀硫酸制取氢气
C.铁粉和稀硫酸制取氢气 D.大理石和稀硫酸制取二氧化碳
15.如图是M、N两种固体物质(不含结晶水)的溶解度曲线,下列说法错误的是 ( )
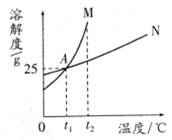
A.图中A点表示M、N两种物质在t1℃时溶解度相等
B.M中含有少量N,通常采用冷却结晶的方法提纯M
C.t2℃时分别将M、N饱和溶液冷却到t1℃,所得溶液的溶质质量分数相等
D.t1℃时,M溶液恒温蒸发10g水析出1g晶体,再恒温蒸发20g水将析出2g晶体
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
16.被称为“第四类新材料”的玉米塑料学名叫“聚乳酸”,它是生物环保材料,可由乳酸(C3H6O3)合成而得,下列说法正确的是 ( )
A.乳酸中C、H、O三种元素的质量比为1:2:1
B.乳酸的相对分子质量为90g
C.90g乳酸完全燃烧时生成的二氧化碳质量132g
D.乳酸是有机高分子化合物
17.除去下列物质中的杂质(括号内为杂质),完全正确的是 ( )
物质
选用试剂
操作方法
A
Cu(CuO)
O2
通入氧气并加热
B
CaO(CaCO3)
――
高温灼烧
C
H2(H2O)
稀硫酸
洗气
D
KCl(K2CO3)
盐酸
加入足量盐酸充分反应后,蒸发结晶
18.“三效催化转换器”可将汽车尾气中有害气体处理为无污染的气体,下图为该反应的微观示意图,其中不同颜色球代表不同种原子。下列说法错误的是 ( )
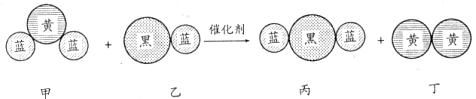
A.乙和丙中所含元素种类相同 B.甲和丁中同种元素化合价相等
C.该反应中共有三种元素 D.反应方程式中乙、丙的化学计量数均为4
19.铅蓄电池中需要一定质量分数的硫酸溶液。现将50%的硫酸溶液(密度为d1g/mL)与10%的硫酸溶液(密度为d2g/mL)按体积比1:1混合,已知d1>d2,所得溶液的溶质质量分数 ( )
A.大于30% B.等于30% C.等于60% D.小于30%
20.向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。则下列说法正确的是 ( )
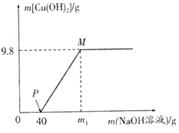
A.整个反应过程中,氯离子个数不变
B.P点溶液中的溶质只有一种
C.M点溶液比P点溶液中氯化钠的质量分数大
D.沉淀完全时,m1的数值为80
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共20分)
21.(6分)根据下表中的相关资料回答问题:
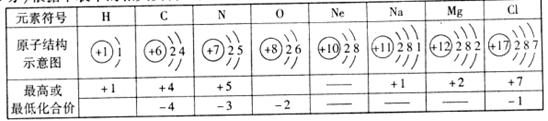
(1)上述元素中属于稀有气体元素的是 。
(2)按照要求用表中元素写化学式。
可能引起温室效应的气体 ;能使湿润的红色石蕊试纸变蓝的气体 ; H、O、Mg组成的一种水垢成分 ;Cl、O组成的自来水消毒剂(Cl显+4价) 。
(3)
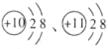 两者关系是 。(填字母) A.同种元素 B.不同种元素
两者关系是 。(填字母) A.同种元素 B.不同种元素
生活中处处有化学。
甲、乙是两种常见商品的标签,请根据要求回答22、23两小题。
22.(4分)图甲是某品牌矿物质水的标签,则:
(1)用离子符号表示其中的一种金属阳离子、一种阴离子 、 。
(2)矿物质水的主要成分是H2O,请说出其中“2”的含义 。
(3)写出有MgSO4生成的一个化学反应方程式 。

23.(3分)图乙是某品牌酸奶的标签,则:
(1)鉴别牛奶和米汤的常用试剂是 。该品牌酸奶中属于碳水化合物的配料是 。
(2)小明喝了一杯(200g)该酸奶,则摄入的蛋白质至少 g。
24.(7分)(1)知识在于积累。下面是玲玲制作的化学知识卡片,请将其补充完整。

(2)甲醇汽油可以减少汽车尾气对环境的污染。某化工厂以甲烷为原料合成甲醇 (CH3OH),并将多余的氢气用于合成氨。请书写有关化学反应方程式:
①甲烷和水蒸气在一定条件下制得CO、H2 ;
②CO、H2在一定条件下化合成甲醇 ;
③高温高压、催化剂的条件下,氮气和氢气合成氨 。
科技改变生活
四、(本题包括2小题,共15分)
25.(8分)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域。工业上从铝土矿中获得物质X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO。则
(1)氮化铝陶瓷属于 。(填字母) A.金属材料 B.无机非金属材料
(2)通常情况下,空气中氮气的体积分数为 ,将经过除尘净化、除去二氧化碳和水蒸气的空气液化,通过控制温度将 (填氧气或氮气)从液态空气中先蒸发出来。
(3)物质X的化学式 ,制AlN的化学反应方程式 。
(4)铝在地壳中的含量居所有元素的第 位。铝元素摄入过多对人体有害,请给大家提一条减少生活中铝元素摄入的合理化建议 。
开发海水宝藏
26.(7分)海水中蕴含80多种元素,是一个巨大的宝藏。
(1)海水晒盐是利用 (填“蒸发结晶”或“冷却结晶”)的方法。
(2)工业上从海水中提取镁的流程如图:
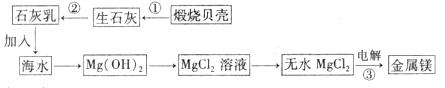
写化学反应方程式:
① ;② ;③ 。
(3)海带中含有丰富的碘,实验室从海带中提取碘的流程如图:

其中操作A的名称为 ,所需要的玻璃仪器有: 、烧杯、玻璃棒。人体必需元素有20多种,缺碘会患 。
五、(本题包括2小题,共25分)
27.(9分)味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑)。请回答 下列问题:
(1)味精中至少含有 种元素(填数字)。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 。(填字母)
A.10 mL B.50 mL C.100 mL
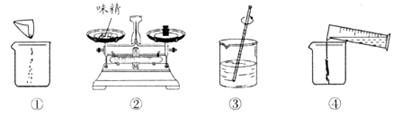
(3)下图是配制过程,正确的操作顺序为 → → → 。 (填序号)
(4)为测定味精中NaCl的质量分数,进行如下实验:
①向所配制的50g溶液中加入过量的AgNO3溶液充分反应(NaCl+AgNO3=AgCl↓+NaNO3),检验沉淀是否完全的方法是:静置后,在上层清液中加入 溶液(填化学式),观察是否有沉淀生成。
②过滤后,洗涤、干燥、称量AgCl固体。洗涤的目的是洗去AgCl固体表面的可溶性杂 质,可溶性杂质中一定有 。
③在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制 溶液的谷氨酸钠质量分数 (填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数 (填“偏大”、“偏小”或“无影响”)。
④经精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为 。
(有关物质的相对分子质量:NaCl―58.5,AgCl―143.5)
28.(16分)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。下面是对铁的腐蚀条件及铁锈组成的探究。
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验。

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧 杯中,微热甲装置,说明气密性良好的现象是 。
(2)反应开始后,甲装置中反应现象是 ,MnO2的作用 。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说 明铁生锈主要与 和 有关。B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 。
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3。某兴趣小组设计如图装置测定锈铁钉的组成。取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少。该过程中仅考虑发生:Fe2O3?H2O Fe2O3+H2O↑,FeCO3
Fe2O3+H2O↑,FeCO3 FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3?H2O―178,FeCO3―116)
FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3?H2O―178,FeCO3―116)
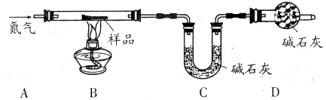
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水蒸气的总质量为 g,D装置中碱石灰的作用是 。
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为 、 。
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成。
①锈铁钉中Fe2O3?H2O的质量= g。
②锈铁钉中FeCO3的质量= g。
③锈铁钉中单质铁的质量分数= 。
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2? (填“有”或“无”),请通过计算说明。(假设铁在H2SO4和Fe2(SO4)3混合溶液中先发生的反应为:Fe+Fe2(SO4)3==3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]