 2007――2008学年度上学期期末检测
2007――2008学年度上学期期末检测
高二化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。试卷满分100分。答题时间90分钟。可能用到的相对原子质量:O:16 H:1 Cl:35.5
Cu:64 Na:23
题号
一
二
三
四
总分
得分
第Ⅰ卷(选择题 共55分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
得分
评卷人
一、选择题(每小题2分,共10分,每小题只有一个选项符合题意)
1、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电,电池负极反应为
A、 B、
B、
C、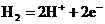 D、
D、
2、已知Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)。在某溶液中含有等物质的量浓度的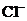 、
、 、
、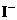 ,当逐滴加入AgNO3溶液时,沉淀先后出现的顺序是
,当逐滴加入AgNO3溶液时,沉淀先后出现的顺序是
A、AgCl,AgI, AgBr B、AgCl,AgBr, AgI
C、AgBr, AgI,AgCl D、AgI,AgBr,AgCl
3、要除去MgCl2酸性溶液里的少量FeCl3,不宜选用的试剂是
A、MgO B、MgCO3 C、NaOH D、Mg(OH)2
4、在冶金工业上,通常均不能用化学还原剂制得的金属组是
A、Na、Ba、Mg、Al B、Na、K、Zn、Fe
C、Zn、Fe、Cu、Ag D、Mg、A1、Zn、Fe
5、已知三种酸HA、HB、HC的电离常数分别为a、b、c,且a>b>c,则对相同浓度的酸溶液叙述正确的是……
A、HC的电离度最大 B、HA溶液酸性最强
C、HC溶液酸性最强 D、三种溶液中酸的电离程度:HA<HB<HC
得分
评卷人
二、选择题(第小题3分,共45分,每小题只有一个选项符合题意)
6、下列说法中正确的是
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③活化分子比普通分子具有较高的能量 ④催化剂降低了反应的活化能 ⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程 ⑥升高温度和使用催化剂都提高了活化分子的百分数
A、①③④⑤ B、②③⑥ C、③④⑤⑥ D、③④⑤

 7、某烯烃与H2加成后的产物是CH3―CH―CH―CH(CH3)2,则该烯烃的结构式可能有
CH3 CH3
7、某烯烃与H2加成后的产物是CH3―CH―CH―CH(CH3)2,则该烯烃的结构式可能有
CH3 CH3
A、1种 B、2种 C、3种 D、4种
8、常温下,一定浓度的某溶液,由水电离出的 ,则该溶液中的溶质可能是
,则该溶液中的溶质可能是
A、 B、
B、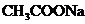 C、
C、 D、
D、
9、下列关于盐酸与醋酸两种稀溶液的说法正确的是
A、相同浓度的两溶液中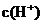 相同
相同
B、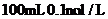 的两溶液能中和等物质的量的氢氧化钠
的两溶液能中和等物质的量的氢氧化钠
C、 的两溶液稀释100倍,
的两溶液稀释100倍, 都为5
都为5
D、两溶液中分别加入少量对应的钠盐, 均明显减小
均明显减小
10、能证明一无色液体是纯净水的方法是
A、电解该液体,得氢、氧两种气体,且氢气跟氧气的体积比为2:1
B、电解该液体,在阴极得到的气体体积为阳极气体体积的2倍
C、在1.01×105Pa测得其沸点是373K
D、实验测得液体的pH=7
11、原电池发生的反应通常是放热反应,下列在理论上可设计成原电池的化学反应是
A、 =
=

B、


C、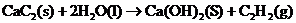

D、

12、下列分子中的14个碳原子不可能处在同一平面上的是
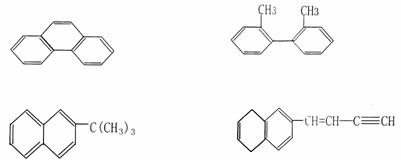
| |||||||||
 13、下列方法能使电离平衡
13、下列方法能使电离平衡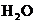
 向右移动,且使溶液呈酸性的是
向右移动,且使溶液呈酸性的是 A(s)+2B(g) C(g)+D(g),已达到平衡状态的是 :
A(s)+2B(g) C(g)+D(g),已达到平衡状态的是 : 17、在密闭容器中发生如下反应mA(g)+nB(g) pc(g),达到平衡后,保持温度不变,将气体体积缩小到原来的二分之一,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是
17、在密闭容器中发生如下反应mA(g)+nB(g) pc(g),达到平衡后,保持温度不变,将气体体积缩小到原来的二分之一,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是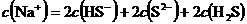
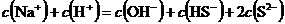
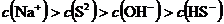
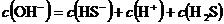
 溶液中:
溶液中: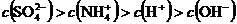
 溶液中:
溶液中: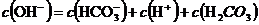
 Cl溶液与0.05mol/L的
Cl溶液与0.05mol/L的 溶液等体积混合,
溶液等体积混合,
 相等的
相等的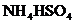 溶液和
溶液和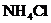 溶液,
溶液,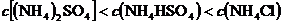
 溶液和300mL0.2mol?L-1的AgNO3溶液,当电解产生
溶液和300mL0.2mol?L-1的AgNO3溶液,当电解产生 由大到小的顺序是
。
由大到小的顺序是
。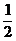 H2( g )→
H2( g )→ 将一定量的该盐溶于水中。
将一定量的该盐溶于水中。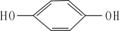 ;
;
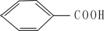
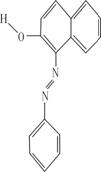 (2)
(2) CH3
CH3
 (3)有机物CH3―CH2―C―CH―CH3的名称:
。
(3)有机物CH3―CH2―C―CH―CH3的名称:
。 (1)A、B两池及各电极的名称:A ,B ,Zn ,Pt 。
(1)A、B两池及各电极的名称:A ,B ,Zn ,Pt 。 溶液,将B中两极都换成铜电极,则工作一段时间后深液的颜色 。(填“加深”“变浅”或“无变化”)。
溶液,将B中两极都换成铜电极,则工作一段时间后深液的颜色 。(填“加深”“变浅”或“无变化”)。 t℃
t℃ 26、(7分)T℃时,有甲、乙两个密闭容器,4min时甲容器的体积为
26、(7分)T℃时,有甲、乙两个密闭容器,4min时甲容器的体积为 (2)Ym-+H2O HY +OH-
(2)Ym-+H2O HY +OH-
