高三化学月考试卷(12月份)
一、选择题:(每小题只有一个正确选项。13X2=26分)
1、下列说法正确的是( )
A、 在化学反应中某元素由化合态变为游离态,该元素一定被还原了
B、 失电子难的原子获得电子的能力一定强
C、 电子层结构相同的各种离子,它的半径随核电荷数的增加而减小
D、 最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼性强
2、反应 
A. 低温、低压 B. 低温、高压
C. 高温、高压 D. 高温、低压
3、 A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是( )
A、A和M原子的电子总数之和可能为11 B、A和M的原子序数之差为8
C、A和M原子的最外层电子数之和为8 D、A和M原子的最外层电子数之差为7
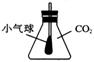 4、锥形瓶配有玻璃导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是 ( )
4、锥形瓶配有玻璃导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是 ( )
A.NaCl B.Mg C.NaHCO3 D.NaOH
5、下列各组性质的比较中,不正确的是( )
A.热稳定性 Na2CO3>NaHCO3>H2CO3 B.熔点 SiO2>NaCl>Na>CO2
C.酸性 H3PO4>H2SO4>HClO4 D.沸点 H2Se>H2S>H2O
6、在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应 X (g) + 3 Y (g)  2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。 则a与b的关系是( )
2 Z (g),到达平衡后, Y的转化率为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %。 则a与b的关系是( )
A. a = b B. a > b C. a < b D. 不能确定
7、在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+
A、+4 B、+
8 、有甲乙两位同学,他们一起做了水果电池的实验,测得以下数据如下:
、有甲乙两位同学,他们一起做了水果电池的实验,测得以下数据如下:
实验次数
电极材料
水果品种
电极间距
电压/mV
1
锌
铜
菠萝
3
900
2
锌
铜
苹果
3
650
3
锌
铜
柑桔
3
850
4
锌
铜
西红柿
3
750
5
锌
铝
菠萝
3
650
6
锌
铝
苹果
3
450
甲同学提出的问题,乙同学解释不正确的是 ( )
甲同学
乙同学
A
实验6中的负极电极反应如何写?
铝为负极,Al-3e-=Al3+
B
实验1,5中电流方向为什么相反?
1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝
C
水果电池的电压与哪些因素有关?
只跟水果的类型有关
D
实验中发光二极管不亮,如何使它亮起来?
可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来
9、沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成C02和H20时,放出445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)ㄔ2CO2(g)+4H20(1) ;△H=+890kJ?mol-1
B.CH4 (g)+202(g)ㄔC02(g)+2H20(1) ;△H=+890kJ?mol-1
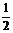
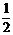 C.CH4(g)+202(g)ㄔCO2(g)+2H20(1) ;△H=一890kJ?mol-1
C.CH4(g)+202(g)ㄔCO2(g)+2H20(1) ;△H=一890kJ?mol-1
D. CH4(g)+02(g)ㄔ C02(g)+H2O(1) ;△H= - 890kJ?mol-1
10.在一定条件下,向密闭容器中充入30mLCO和20mL水蒸气使其反应,当CO + H2O CO2 + H2达到平衡时,CO的体积分数为40%,则下列叙述错误的是 ( )
CO2 + H2达到平衡时,CO的体积分数为40%,则下列叙述错误的是 ( )
A.平衡后水蒸气的体积分数与H2相等 B.平衡后水的转化率为50%
C.平衡后CO的体积与CO2相等 D.平衡后CO2的体积分数为20%
11、500ml
KNO3和Cu(NO3)2 的混合溶液中c(NO3―)=6.0mol?L-1 ,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到
A.原混合溶液中c(K+)为1mol?L-1 B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液中c(H+)为2mol?L-1
12、下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.温度相同、密度相等的CO和C2H4 D.压强相同、体积相同的O2和H2
13、设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.
B.100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,
D.
14、下列在指定溶液中的各组离子,能够大量共存是
A.无色溶液中:HCO3-、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+)=10-12mol?L-1的溶液中:Fe3+、SO42-、K+、SCN-
二、选择题:(每小题有一到两个正确选项。10X3=30分 )
15、能正确表示下列反应的离子方程式是
A.向偏铝酸钠溶液中滴加过量盐酸:AlO2-+4H+ Al3++2H2O
Al3++2H2O
B.用NaOH溶液吸收少量二氧化碳气体:OH-+CO2 HCO3-
HCO3-
C.足量铁粉加入少量的稀硝酸中:3Fe+4H++2NO3- 3Fe2++2NO↑+2H2O
3Fe2++2NO↑+2H2O
D.向沸水中滴加少量饱和氯化铁溶液:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
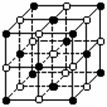 16、KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2 - 代替,下列对KO2晶体结构的描述正确的是
16、KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,Cl -的位置用O2 - 代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O2 -共有8个
B.和K+距离相同且最近的K+共有12个
C.和K+距离相同且最近的O2 ?构成的多面体是正八面体
D.和K+距离相同且最近的O2 ?构成的多面体是正六面体
17、在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g) 2SO3(g) ;△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
( )
2SO3(g) ;△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
( )
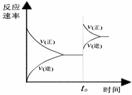

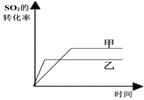
I II III
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图III研究的是温度对化学平衡的影响,且乙的温度较低
18、对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 ( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
19、将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为:CH4+10OH??8e-=CO32-+7H2O;
通入氧气的另一极,其电极反应式是2O2+4H2O+8e-=8OH-。
下列叙述正确的是
A.通入甲烷的电极为负极
B.正极发生氧化反应
C.该燃料电池总反应为:CH4+2O2+2OH-=CO32-+3H2O
D.燃料电池工作时,溶液中的阴离子向正极移动
20、下列离子方程式正确的是 ( )
A.钠与水反应 Na+2H2O=Na++2OH-+H2↑
B.澄清石灰水中加入少量小苏打溶液2HCO3-+Ca2++2OH-?CaCO3↓+CO32-+H2O
C.硫化亚铁与稀硫酸反应FeS+2H+?Fe3++H2S↑
D.碳酸氢钠溶液中滴加烧碱溶液HCO3-+OH-?CO32-+H2O
21、已知0.1 mol?L-1的二元酸H
则下列说法中正确的是 ( )
A.在Na
B.在溶质物质的量相等的Na
C.在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH- ]+2[A2-]
D.在Na
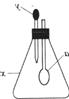 22、下图中,锥形瓶内盛有气体x,滴管内盛有液体y,若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是
(
)
22、下图中,锥形瓶内盛有气体x,滴管内盛有液体y,若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是
(
)
A.x是NH3,y是浓氨水 B.x是S02,y是氢氧化钠浓溶液
C.x是C02,y是稀硫酸 D.x是HCl,y是NaN03稀溶液
23、将a g Fe2O3、Al2O3样品溶解在过量的200 mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+ 刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为 ( )
A.0.1 mol?L-1 B.0.2 mol?L
C.0.4 mol?L-1 D.0.8 mol?L-1
 高三月考试卷(12月份)
高三月考试卷(12月份)
第一卷:选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
答案
第二卷: 非选择题
24.(7分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸 生成外,其他的生成物还有 。
B
A
X
C
D
25、(9分)A、B、C、D四种元素在周期表中分别处于元素X的四周(如图)已知元素X最高价氧化物的化学式为X2()5,且五种元素中有一种元素的原
子半径是它们所处的同族元素中最小的。
确定:(1)写出各元素的名称:A B C D X 。
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为 。
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为 。
 26、(9分)(1)有右下图所示A、B、C、D四种仪器:
26、(9分)(1)有右下图所示A、B、C、D四种仪器:
请选择下列仪器名称的序号,填人相应的空格内:
①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管 A______________B____________C____________D______________
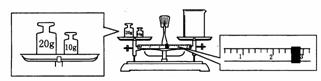
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g.
(3)指出下面3个实验中各存在的一个错误:
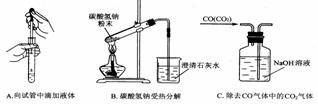
A__________________________,B__________________________,C___________________________
27.(分)已知某溶液中含有4种离子:A+、B一、H+、OH一,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B+组成物质的化学式(只写一种情况,可以是一种溶质,或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)[B- ]>[A+]>[H+]>[OH- ]: 、
(2)[A+]>[B- ]>[OH- ]>[H+]: 、
(3)[H+]>[B- ]>[A+]>[OH- ]: 、
28.(4分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) +
D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
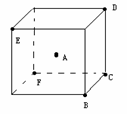 29.(6分)如图所示的正立方体中有A~F六个点,其中点A处于立方体的中心,点B~F均处于立方体的顶点,请从A~F六个位置中选择合适的位置,放置相应的原子模型来表示CO2和CH4的分子空间构型。
29.(6分)如图所示的正立方体中有A~F六个点,其中点A处于立方体的中心,点B~F均处于立方体的顶点,请从A~F六个位置中选择合适的位置,放置相应的原子模型来表示CO2和CH4的分子空间构型。
(1)、 点放置碳原子, 点放置氧原子,可表示CO2的分子空间构型。
(2)、 点放置碳原子, 点放置氢原子,可表示CH4的分子空间构型。
(3)写出CO2和CH4的电子式 、 。
30.(7分)按要求回答下列问题:
(1)0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。