摘要:已知0.1 mol?L-1的二元酸H2A溶液的pH=4.0.则下列说法中正确的是 A.在Na2A.NaHA两溶液中.离子种类不相同B.在溶质物质的量相等的Na2A.NaHA两溶液中.阴离子总数相等C.在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH- ]+2[A2-]D.在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH- ]
网址:http://m.1010jiajiao.com/timu_id_38225[举报]
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- ![]() H++A2-
H++A2-
回答下列问题:
(1) Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是____________________________________________(用离子方程式表示)
(2) 在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A c(A2-) +c( HA-)+c( H2A) =0.1mol?L-1 B c(OH-)=c(H+) +c( HA-)
C c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D c(Na+ )= 2c(A2-) +2c( HA-)
(3) 已知0.1mol?L-1NaHA溶液的pH=2,则0.1mol?L-1 H2A溶液中氢离子的物质的量浓度可能是_______ 0.11 mol?L-1(填“〈”,“〉”,或“=”),理由是:
____________________________________________________________
(4) 0.1mol?L-1 NaHA溶液中各种离子浓度由大到小的顺序是:____________________
查看习题详情和答案>>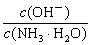 增大
增大