淮安市2006―2007学年度高三年级第四次调查测试
化 学 试 题 2007.5
本试卷分为第I卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试时间120分钟。
可能用到的相对原子质量:H 1 D
第I卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、走一条可持续发展的道路,是我国社会经济保持长期稳定、健康发展的必然选择。下列举措中有背于这一指导思想的是( )
A、加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B、研制乙醇汽油(汽油中添加一定比例的乙醇)技术,降低机动车辆尾气中有害气体排放
C、生产、生活中,努力实现资源的循环利用
D、利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
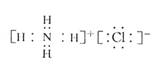
 2、下列化学用语的表示中,不正确的是( )
2、下列化学用语的表示中,不正确的是( )
A、氢负离子(H-)结构示意图 B、氯化铵的电子式
C、甲酸乙酯的结构简式:C2H5OOCH D、N2的电子式N:::N
 3、赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O △ 6Cu+SO2↑。下列关于该反应的说法中,正确的是:
3、赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O △ 6Cu+SO2↑。下列关于该反应的说法中,正确的是:
A、Cu2S在反应中既是氧化剂,又是还原剂 B、Cu既是氧化产物又是还原产物
C、该反应中氧化剂只有Cu2O D、每生成19.2gCu,反应中转移0.6mol电子
4、化学实验中的安全意识是重要的科学素养。下列实验操作或事故的处理中正确的是( )
A、稀释浓硫酸时,将水沿器壁慢慢注入浓硫酸中,并以玻璃棒不断搅拌
B、不慎将酒精或苯等有机物洒在实验台上着火时,立即用水浇灭
C、皮肤上与不慎沾了苯酚或液溴,立即用浓NaOH溶液清洗
D、钾、钠等着火时,立即用干燥的沙子扑灭
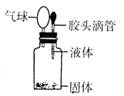 5、某同学如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是( )
5、某同学如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是( )
A、铜与浓硫酸 B、铁与浓硫酸
C、铝和氢氧化钠溶液 D、二氧化锰和浓盐酸
6、下列叙述中,正确的是( )
A、酶具有很强的催化功能,胃蛋白酶只能催化蛋白质的水解,
B、医疗上的血液透析是利用胶体的性质,而土壤的保肥与胶体的性质无关
C、银制品久置于干燥空气中因电化学腐蚀而使表面变暗
D、二氧化硅是生产光导纤维的主要原料
7、已知t℃,盐A(不含结晶B,M(A)=
A、b=
100-S 1000ρ 126(100+S)
8、已知101kPa下有:H2(g)+1/2 O2(g)=H2O(g);△H=-241.8kJ/mol。则下列说法或表达中正确的是( )
A、H2的燃烧热为241.8kJ/mol
B、H2(g)+1/2O2(g)=H2O(l);△H<-241.8kJ/mol
C、2H2(g)+O2(g)=2H2O(g);△H>-241.8kJ/mol
D、1molH2与1/2molO2的总能量小于1molH2O(g)的总能量
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、若以R、M分别代表某一元素,下列说法中正确的是( )
A、若存在简单阴离子R-,则R一定属于VⅡA族
B、若存在简单阴离子R2-,则R一定属于VⅠA族
C、若存在简单阳离子M+,则M一定属于IA族
D、若存在简单阳离子M2+,则M一定属于ⅡA族
10、阿伏加德多常数约为6.02×1023mol-1,下列叙述中正确的是( )
A、标准状况下,11.2LNO2与N2O4混合气体中所含分子数约为5×6.02×1022
B、
C、
D、
11、工业上冶炼金属一般有热分解法、热还原法和电解法。由于金属的化学活动性不同因此选择不同的冶炼方法。你认为选择的原则主要是依据( )
A、金属阳离子得电子的能力 B、金属熔点的高低
C、金属在自然界的存在形式 D、金属元素在地壳中的含量
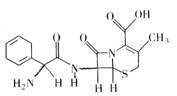 12、头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是( )
12、头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是( )
A、分子式为C16H20N3O4S
B、该物质在一定条件下能发生水解
C、该有机物质属于芳香族化合物
D、该物质能与NaHCO3溶液反应放出CO2
13、若已知在相同温度下,S[Zn(OH)2]>S(ZnS),S(MgCO3)>S[Mg(OH)2];就溶解或电离出S2-的能力,有FeS>H2S>CuS。则下列离子方程式错误的是( )
A、Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O B、Cu2++H2S=CuS↓+2H+
C、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ D、FeS+2H+=Fe2++H2S↑
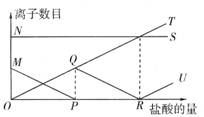 14、向一定量的K2CO3溶液中缓缓滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中相关离子的数目也相应地发生变化(如图)。图中各条曲线与溶液中离子数目的变化对应关系中,正确的是( )
14、向一定量的K2CO3溶液中缓缓滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中相关离子的数目也相应地发生变化(如图)。图中各条曲线与溶液中离子数目的变化对应关系中,正确的是( )
A、NS:K+,MP:H+,QR:CO32-,OT:HCO3-,RU:Cl-
B、NS:K+,MP:CO32-;OQR:HCO3-,OT:Cl-,RU:H+
C、NS:K+,MP:Cl-,QR:H+,OT:HCO3-,RU:CO32-
D、NS:K+,MP:H+,OQR:Cl-,OT:CO32-,RU:HCO3-

 15、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O则下列说法
15、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O则下列说法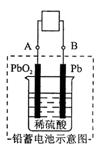 正确的是( )
正确的是( )
A、放电时:电子流动方向由B经外电路到A
B、放电时:正极反应是Pb-2e-+SO42-=PbSO4
C、充电时:铅蓄电池的负极应与充电器电源的正极相连
D、充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
16、在一个体积为
 |
第Ⅱ卷 (非选择题,共84分)
三、(本题包括2小题,共22分)
17、(10分)现有下列仪器或用品:a.铁架台(含铁圈、铁夹)b. 锥形瓶 c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计
现有下列试剂:A、NaOH固体 B、碳酸钠溶液 C、氯化镁溶液 D、蒸馏水
试填空:
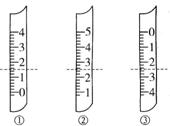 (1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是______________。
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是______________。
A、①是量筒,读数为1.5mL
B、②是量筒,读数为2.5mL
C、③是滴定管,读数为2.50mL
D、②是温度计,读数是
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是________。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用的试剂是:________(选填序号),操作方法是__________、_________洗涤。完成上述操作,上述仪器或用品用到的有__________(从上述仪器或用品中选择,并填上相应序号)。
18、(12分) N2在化工生产、农业、医疗、航天航空等诸多领域用途广泛。某化学兴趣小组同学为探究在实验室制备较为纯净N2,进行了认真的准备。请你参与交流与讨论。
[查阅资料] N2的制法有下列三种方案:
方案1:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案2:加热NaNO2和NH4Cl的浓溶液制得N2。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
 [实验准备] 以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。
[实验准备] 以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。
[分析交流]
(1)若按方案1制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的顺序连接的顺序是(填写序号,下同)____
___________。获得N2的反应原理是_________________________________。
(2)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是____________________________________。你提出的收集方法是_____________
______________________________________。
(3)若以方案(2)制得N2,应选择的发生装置是__________。为保证实验顺利进行,操作时应____________________________________________________
______________________________(请至少填写两点)。
(4)上述三个方案中,制得的N2纯度最差的是__________。在N2纯度要求不甚严格的情况下,有人建议将方案1和方案3结合使用,你认为其优越性在于__
__________________________________________________________________。
四、(本题包括2小题,共18分)
19、(8分)已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC、AC2;BC、BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。
(1)下列关于AC、AC2、BC、BC2的叙述中正确的是_______(填序号)
A、它们都属于极性分子 B、从某一视角看它们可分为一类物质
C、它们都是大气污染物 D、它们都可以通过化合反应获得
(2)你认为B、C、D元素形成的化合物能否_______(填“能”或“不能”发生下面的反应:BC+BD3→DBC2+D
___________________________________________________________________。
(3)恒温恒压下,在密闭容器中发生下列反应:
+B2(g)。在上述条件下,向容器中充入AC和BC2各1mol,达平衡时,生成AC2和B2共a mol,则AC的转化率是__________(用a的代数式表示)。你知道的该反应的一个重要应用是________________________________________________ _____。
21、(10分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观酷似冰的甲烷水合物。我国南海海底有丰富的“可燃冰”资源。取
(2)甲醇是重要的基础化工原料,又是一种新型的燃料,制取甲醇的传统方法是采用
催化剂

 CuO――ZnO/r――Al2O3为催化剂,合成反应为:CO+2H2 CH3OH。
CuO――ZnO/r――Al2O3为催化剂,合成反应为:CO+2H2 CH3OH。
加热、加压
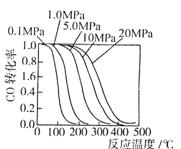 生产中一些工艺参数如图所示。该反应为___________(填“吸热”或“放热” )反应。说明你作出判断的依据____________________________________________。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为___________________________________。电池工作时,固体电解质里的O2-向_______极推动。
生产中一些工艺参数如图所示。该反应为___________(填“吸热”或“放热” )反应。说明你作出判断的依据____________________________________________。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为___________________________________。电池工作时,固体电解质里的O2-向_______极推动。
(3)能源的紧缺在很大程度上制约了我省经济的发展,请你提出解决江苏能源紧缺问题的两点建议___________________________
____________________________________________________________________。
六、(本题包括2小题,共18分)
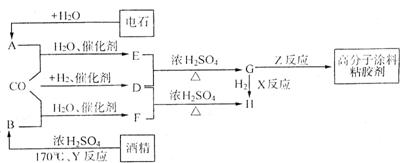 22、(9分)CO不仅是家用煤气的主要成分,也是重要的化工原料。近年来报导了一种低温低压催化工艺,可把某些简单的有机物经“羰化”反应后可合成一类具有优良性能的有机化工产品(如装饰性高分子涂料、粘合剂等)。如下图所示:
22、(9分)CO不仅是家用煤气的主要成分,也是重要的化工原料。近年来报导了一种低温低压催化工艺,可把某些简单的有机物经“羰化”反应后可合成一类具有优良性能的有机化工产品(如装饰性高分子涂料、粘合剂等)。如下图所示:
图中G(RCOOR)的一种同分异构体是E的相邻同系物,H的一种同分异构体则是F的相邻同系物;D由CO和H2按物质的量之比为1:2完全反应而成;H是含有4个碳原子的化合物。
请回答下列问题:
(1)写出化合物H的结构简式___________________________。
(2)反应类型:X_______________,Y______________。
(3)与G同类别且能发生银镜反应的同分异构体的结构简式_____________、________________________。
(4)写出下列反应的化学方程式:
 ①A+CO+H2O 催化剂 E:____________________________________。
①A+CO+H2O 催化剂 E:____________________________________。
② Z反应:____________________________________________。
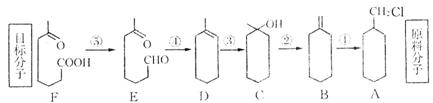 23、(9分)历史上已有5次将诺贝尔化学奖授予了有机合成领域的化学家。为了使有机合成路线短、副产物少,通常用逆推法进行合成路线的设计。6-羰基庚酸是合成某些高分子材料和药物的重要中间体。其合成路线按逆推法设计如下图所示:
23、(9分)历史上已有5次将诺贝尔化学奖授予了有机合成领域的化学家。为了使有机合成路线短、副产物少,通常用逆推法进行合成路线的设计。6-羰基庚酸是合成某些高分子材料和药物的重要中间体。其合成路线按逆推法设计如下图所示:
请回答下列问题:
(1)上述原料分子仍可逆推至更为常见的有机合成原料,其结构简式为___ __。
该物质转化为原料分子可分两步进行,第一步反应的条件是_____________________。
(2)由B至D除上述途径外,还有另一条反应途径,例如:
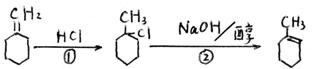
由上述①②反应可顺利完成,你能发现相关的有机反应的经验规律是___ ___
_____________________________________ ______________________。
(3)写出E→F反应的化学方程式:________________________ ________。
七、(本题包括2小题,共18分)
24、(8分)用沉淀法测定NaHCO3和K2CO3均匀混合物的组成。实验中每次称取样品的质量,向所配溶液中加入的Ba(OH)2溶液的体积、生成对应沉淀的质量等实验数据如下表所示。
实验序号
1
2
3
4
5
样品质量/g
a
2.574
V[Ba(OH)2(aq)]/L
0.5
0.5
0.5
0.5
0.5
沉淀质量/g
b
2.758
3b
4b
4b
试完成下列问题:
(1)b=______g。
(2)样品中n(NaHCO3):n(K2CO3)=_______________。
(3)
25、(10分)石油化工是江苏省的支柱产业之一,醋酸乙烯酯是合成维尼纶的重要单体。某化
|

 2CH2=CH2+O2
2CH3CHO ① 2CH3CHO+O2
催化剂 2CH3COOH ②
2CH2=CH2+O2
2CH3CHO ① 2CH3CHO+O2
催化剂 2CH3COOH ② (4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)
(4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)

 nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)
nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)