网址:http://m.1010jiajiao.com/timu_id_36813[举报]
一、选择题:(4分×8=32分)
1、D 2、D 3、A 4、C 5、C 6、D 7、A 8、B
二、选择题:(4分×8=32分)
9、B 10、AD 11、A 12、BD 13、C 14、B 15、AD 16、D
三、(本题包括2小题,共22分)
17、(10分)(1)A、D(2分) (2)容量瓶(1分)
(3)C、D(2分) 溶解、过滤(2分) a.d.e.h.j (3分)
18、(12分)(1)E→D→B→C(2分) 2NH3+3CuO=3Cu+N2↑+3H2O(2分)
(2)N2的相对分子质量28与空气的平均相对分子质量相近(1分)。以塑料袋直接收集(1分)
(3)A (1分) 将分液漏斗上部活塞凹槽与口部小孔相对;检查装置的气密性;向烧瓶内加少许碎瓷片。(2分)
(4)方案3(1分) CuO和Cu可循环反复利用,节省药品(2分)
四、(本题包括2小题,共18分)
19、(8分)(1)BD(2分)(2)不能(1分) 正2价氮不能将负3价氮氧化至正3价氮(2分) (3)
20、(10分)(1)FeSO4?7H2O (3分) (2)野外焊接钢轨(1分)
(3)Cl2+SO2+2H2O=2Cl-+SO42-+4H+(2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(4)常温下浓硫酸使铝、铁钝化(2分)
五、(本题包括1小题,共10分)
21、(10分)(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.3kJ/mol(2分)
(2)放热(1分)由图知,不论在何种压强下,都是温度越高,CO的转化率越小(2分) O2+4e-=2O2-(2分) 负(1分)
(3)开发新能源,例如核能、太阳能等(1分),加大能源消耗大户的节能改造(1分)
六、本题包括2小题,共18分)
22、(9分)(1)CH3CH2COOCH3(1分)(2)加成,消去(2分)
(3)HCOOCH=CHCH3,HCOOCH2CH=CH2(2分)
 (4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)
(4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)



 nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)
nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)
COOCH3
23、(9分)(1)CH3 (2分) 光照(1分)
(2)烯烃与卤化氢(HCl)加成,H原子总是加在连接H原子较多的不饱和C原子上(H加H多)(2分)
消去HX时,X原子总是和含H原子较少的相邻碳原子上的H消去(H去H少)(2分)
 |
(3) (2分)
七、(本题包括2小题,共18分)
24、(8分)(1)1.379( 分) (2)
(1)b=
(2)m(400)=3.432
n(NaHCO3)=x mol, n(K2CO3)=y mol
84x+138y=3.432
x+y=0.028
84x0.028+54y=3.432
y=0.02
x=0.008
即 n(NaHCO3):n(K2CO3)=0.008:0.02
=2:5
(3)第三次实验的样品中:
n(NaHCO3)=0.008×3/4=0.006 mol
n(K2CO3)=0.02×3/4=0.015 mol
n[Ba(OH)2]=0.028 mol
=》n(OH-)=0.056 mol
反应中消耗OH-物质的量为0.006 mol
剩余OH-物质的量为0.056-0.006=0.05 mol
所取1/10滤液中n(OH-)=0.005 mol
稀释至500mL后 c(OH-)=0.005/0.5=0.01mol/L
pOH=2 pH=14-2=12
25、(10分)(1)5:3(4分)(2)2.42×
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS | Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
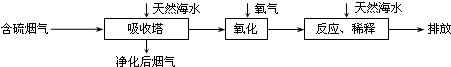
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图.
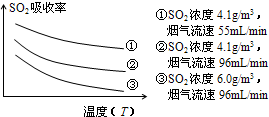
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是
(1)研究发现,化学反应伴随着能量的变化,许多化学反应的能量变化主要是表现为
(2)燃气公司要把一套以煤气(主要成分是CO、H2)为燃料的灶具改为以天然气为燃料的灶具时,灶具应作相应调整,合理的方法是
a.增大空气的进入量
b.增大天然气的进入量
c.空气和天然气的进入量都减小
(3)目前,石油和煤不仅是主要的能源,也是重要的化工原料.下列石油或煤的加工过程中,能够得到苯的是
a.石油的裂解 b.煤的干馏 c.石油的分馏
(4)已知某地区酸雨污染比较严重.分析该地区降雨的成分发现,雨水中的阴离子以硫酸根离子为主,约占阴离子总量的62%;阳离子以铵根离子为主,约占阳离子总量的84%.阴离子中SO42-和NO3-的质量比约为4.13:1,且NO3-的比例呈明显上升的趋势.
①该地区大气污染的特征是
a.煤烟型
b.机动车尾气型
c.由煤烟型向煤烟型与机动车尾气混合型转化
②请你给出该地区防治酸雨的两条主要措施:
③某研究小组拟选择“不同地点空气中二氧化硫的含量分析”为课题进行探究.如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是
(5)汽车尾气中含有氮氧化物和一氧化碳等有害气体,在加装了汽车尾气处理装置后,可以使尾气中的有害成分在催化剂作用下转化为N2、CO2排出.现在有NO、NO2、CO三种气体组成的混合气甲40.32L(标准状况下),在催化剂存在下充分反应后,得到无色无毒的混合气乙,再将乙通入到足量的石灰水中生成100g沉淀,则原混合气甲中NO与NO2的体积比为
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为 。
(2)为探究反应6H2(g)+2CO2(g)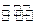 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验: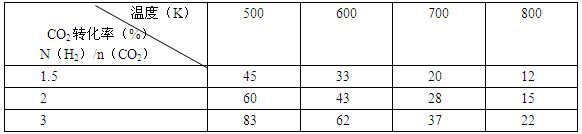
根据表中实验数据分析:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有 (写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)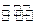 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是 。
A.该反应的平衡常数表达式为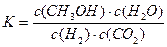 |
| B.CO2的平衡转化率为40% |
| C.2min内H2的平均反应速率为0.3mol/(L·min) |
| D.该反应达到平衡状态的标志是混合气体的密度不发生改变 |
 查看习题详情和答案>>
查看习题详情和答案>>
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1) C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1) C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为 。
(2)为探究反应6H2(g)+2CO2(g)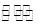 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
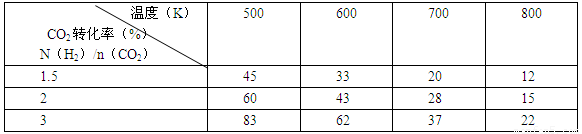
根据表中实验数据分析:
①该反应的正反应为 (填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有 (写出一条即可)。
(3)一定条件下,将3 mol H2 和1mol CO2气态混合物充入2L 密闭容器中,发生如下反应:3H2(g)+CO2(g)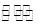 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是
。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是
。
A.该反应的平衡常数表达式为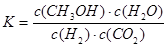
B.CO2的平衡转化率为40%
C.2min内H2的平均反应速率为0.3mol/(L·min)
D.该反应达到平衡状态的标志是混合气体的密度不发生改变
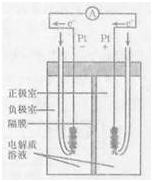
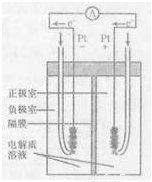
(4)右图是甲烷燃料电池的工作原理示意图,电解质溶液为KOH溶液。则负极室通入的气体是 (填“甲烷”或“氧气”);正极室电极上发生的电极反应是 ;其电池的总反应为 。比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是能量转化效率高,其次是 。
查看习题详情和答案>>