2009届湖南宁乡县期末调研考试高中三年级化学试卷
本试卷包括试卷和答题卷,共21个小题,满分100分,考试时间90分钟。
考试结束后,请考生将试卷自行保存,交答题卷。
注意事项:
1、 在进行答题前,请考生务必将自己的姓名、考号、座位号和答案用钢笔或圆珠笔填写到答题卷上的相应栏目内,并按答题要求进行作答,不得答在试卷上。
2、 可能用到的数据: H-1 C-12 O-16 S-32 Cu-64 Ba-137
一、选择题: (本题包括15个小题,每小题3分,总共45分,每小题只有一个选项符合题意,请将符合题意的选项填在答题卷的相应位置。)
1.2007年9月,美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是21世纪人类最伟大的发现之一,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是
A.分子间作用力 B.氢键
C.非极性共价键 D.极性共价键
2. 最近,食品安全问题引起广泛关注。下列做法正确的是
A.用硫磺熏制白净的粉丝
B.用福尔马林保鲜海产品
C.腌制食品中严格控制NaNO2的用量
D.用三聚氰胺作食品添加剂,以提升食品检测中的蛋白质含量指标,
3.下列不属于新型有机高分子材料的是
A.高分子分离膜 B.液晶高分子材料
C.生物高分子材料 D.有机玻璃
4.下列划线部分物质在充分反应后能完全消耗的有
A.1mol MnO2与含4mol HCl的浓盐酸加热反应
B. 1mol 无水C2H5OH与2mol冰醋酸在浓H2SO4作用下加热
C.少量淀粉酶加入含
D.含少量CO2的1molCO气体与1mol Na2O2密封在容器中,不断电火花点燃
5.有机物:  的正确命名为
的正确命名为
A.3,3,―二甲基―4―乙基戊烷 B.3,3,4―三甲基已烷
C.2―乙基―3,3―二甲基―4―乙基戊 D.2,3,3―三甲基已烷
6.下列叙述中错误的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应;
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极;
C.电镀时,电镀池里的阳极材料发生氧化反应;
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气。
7.2008年4月,我国科学家利用裂解三聚氰胺(C3N6H6)的方法,获得了热稳定性高于1700℃的碳氮化合物(Q),其中氮、碳元素的质量比为1.56:1,从而奠定了碳?植被的大规模合成的基础,下列有关说法中不正确的是
A.Q的晶体可能是原子晶体 B.Q的化学式为C3N4
C.C3N6H6转化为Q的反应是分解反应 D.Q材料不可用于制造坩埚
 8.下列物质中,既能与NaOH反应,又能与HNO3反应,还能发生水解反应的是
8.下列物质中,既能与NaOH反应,又能与HNO3反应,还能发生水解反应的是
①H2S;②Al2O3;③AlCl3; ④NaHS; ⑤甘氨酸;⑥ ;⑦葡萄糖;⑧纤维素;⑨蛋白质
A.③④⑤⑥⑧⑨ B.④⑥⑨
C.⑤⑥⑧⑨ D.全部
 9.M是一种治疗艾滋病的新药,结构简式如下图所示。已知M分子中―NH―COO―基(除H外)与苯环在同一平面内,关于M的以下说法正确的是
9.M是一种治疗艾滋病的新药,结构简式如下图所示。已知M分子中―NH―COO―基(除H外)与苯环在同一平面内,关于M的以下说法正确的是
A.该物质易溶于水
B.M的分子式为C13H12O2NF4
C.M能发生加聚反应
D.M分子内所有碳原子可能在同一平面内
10.玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,下列实验中至少用到其
中两个用途的是
①配制一定物质的量浓度的溶液 ②硫酸铜晶体结晶水含量的测定
③用硫酸铜和氢氧化钠制取氧化铜 ④从制取氧气的剩余固体中提取KCl
⑤测定溶液的pH ⑥浓盐酸与浓氨水相遇发烟
A.①③④ B.②④
C.只有④ D.全部错误
11.某些芳香族化合物的分子式均为C7H8O,其中与FeCl3溶液混合后显色与不显色的结构分别有
A.2种和1种 B.2种和3种
C.3种和2种 D.3种和1种
12.下列实验方法不合理的是
A.测定废水中Fe2+含量时,将酸性KMnO4溶液装在酸式滴定管中进行标定
B.可用稀盐酸鉴别同浓度的Na2CO3溶液和NaHCO3溶液
C.油脂皂化后可用盐析的方法使高级脂肪酸钠和甘油充分分离
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量相等
13.食品香精菠萝酯的生产流程(反应条件略去)如下:

下列叙述错误的是
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
 14.固体氧化物燃料电池(SOFC)以固体氧化物作
14.固体氧化物燃料电池(SOFC)以固体氧化物作
为电解质。其工作原理如右图所示:下列关于固
体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为:
O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为 H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
15.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2mol?L-1H2SO4溶液 B.18 mol?L-1H2SO4溶液
C.6 mol?L-1KOH溶液 D.3 mol?L-1HNO3溶液
二、非选择题(本题共6小题,共55分)
16.(10分)氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制,实验室配制新制的氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是______________________________。
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动。
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:_____________________________________。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为b g,比较a、b关系。
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为以上4 个方案中,合理的方案是________________。
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如下图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):_________。
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量

(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂――蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:_________________________。(1)确保氢氧化钠过量(2)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3
(3)②③⑤
17.(7分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、C1―、NH4+、Mg2+、Ba2+、SO42―、CO32CO32―。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号
实验内容
实验结果
1
加AgNO3溶液
有白色沉淀生成
2
加足量NaOH溶液并加热
收集到气体
3
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量
第一次称量读数为6.
试回答下列问题:
(1)根据实验1对C1―是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1―3判断混合物中一定不存在的离子是 。
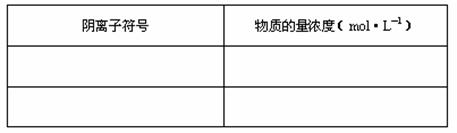
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号
物质的量浓度(mol?L―1)
(3)试确定K+是否存在? ,判断的理由是
。
(1)不能确定:Ba2+、Mg2_
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(3)存在:溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(每空1分)
18.(10分)请回答下列化工知知识.
(1)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 ________________________________;如果用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 _________________________,该方法的优点是________________________;
(2)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。阳离子膜和隔膜均允许通过的
分子或离子是______________,电解槽中的阳极材料为 ____________________;
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,
其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与____________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为_____________。
Fe3++H2S = S↓+2Fe2++2H+, (2分) Na2S+2H2O S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2分)
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2分)
(2)阳离子(Na+),钛(或石墨); (2分) (3)4, 正四面体。 (2分)
19.(8分)氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:

(1)写出A、B之间发生反应类型:_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_______。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)_______________。
(1)铝热 (置换)反应 (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (4)H2SO4(或HNO3)
20.(12分)糖精的制造过程是从煤焦油中提炼出甲苯,再用甲苯为原料,经过硫酸磺化,再用KMnO44氧化和五氯化磷及氨处理后,最后经结晶、脱水得到。化学名称是邻-磺酰苯甲酰亚胺。合成过程如下图所示:

(1)写出①的化学反应方程式:______________反应类型:____。
(2)方框中的物质是_______(写结构简式),反应②的条件可以是____。
(3)糖精的分子式是:______,写出制取糖精的最后一步反应方程式:_________________________。
21.(8分) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(1) 3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2分)
(2) 16 g (2分) (没单位扣1分)
(3) 0.1 mol (2分)(没单位扣1分)
(4) 0.05<n<0.15(2分)
|

 (2)
(2)
 S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)