网址:http://m.1010jiajiao.com/timu_id_576682[举报]
一、选择题:(本题包括15个小题,每小题3分,总共45分,每小题只有一个选项符合题意,请将符合题意的选项填在答题卷的相应位置。)
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
B
B
D
B
题号
9
10
11
12
13
14
15
答案
C
A
C
D
D
D
A
二、非选择题(本题包括6小题,共55分)
16.(10分)(1)确保氢氧化钠过量 (2分)
(2)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3 (4分)
(3)②③⑤ (2分)
(4)在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分。 (2分)
17.(7分)(1)不能确定 (1分) : Ba2+、Mg2+ (1分)
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(2分)
(3)存在: (1分)
溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(2分)
18.(10分)Fe3++H2S = S↓+2Fe2++2H+,(2分) Na2S+2H2O S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
(2)阳离子(Na+),钛(或石墨); (2分) (3)4, 正四面体。 (2分)
19.(8分)(1)铝热 (置换)反应(2分) (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+(2分)或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (2分) (4)H2SO4(或HNO3) (2分)
20.(12分)
21.(8分)(1) 3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2分)
(2)16 g (2分) (没单位扣1分) (3)0.1 mol (2分)(没单位扣1分)
(4)0.05<n<0.15(2分)
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B = C = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)
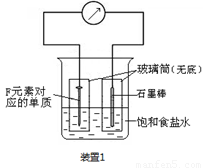
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
查看习题详情和答案>>
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)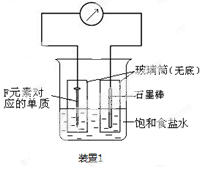
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 。
Ⅰ.原子半径:A < C < B < E< D
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)

(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
(11分) (1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
|
项目 |
熔点/℃[来源:Z。xx。k.Com] |
硬度 |
水溶性 |
导电性 |
水溶液与Ag+反应 |
|
A |
811 |
较大 |
易溶 |
水溶液(或熔融)导电 |
白色沉淀 |
|
B |
3 500 |
很大 |
不溶 |
不导电 |
不反应 |
|
C |
-114.2 |
很小 |
易溶 |
液态不导电 |
白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A________ ____;B_______ ___;C____ ____。
② 晶体中粒子间的作用分别为:
A______ ___;B______ __;C_______ _。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
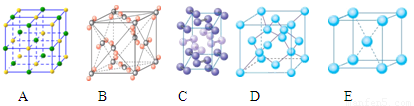
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
查看习题详情和答案>>
(11分)(1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
| 项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| B | 3 500 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A________ ____;B_______ ___;C____ ____。
② 晶体中粒子间的作用分别为:
A______ ___;B______ __;C_______ _。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
查看习题详情和答案>>