网址:http://m.1010jiajiao.com/timu_id_576679[举报]
一、选择题:(本题包括15个小题,每小题3分,总共45分,每小题只有一个选项符合题意,请将符合题意的选项填在答题卷的相应位置。)
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
B
B
D
B
题号
9
10
11
12
13
14
15
答案
C
A
C
D
D
D
A
二、非选择题(本题包括6小题,共55分)
16.(10分)(1)确保氢氧化钠过量 (2分)
(2)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3 (4分)
(3)②③⑤ (2分)
(4)在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分。 (2分)
17.(7分)(1)不能确定 (1分) : Ba2+、Mg2+ (1分)
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(2分)
(3)存在: (1分)
溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(2分)
18.(10分)Fe3++H2S = S↓+2Fe2++2H+,(2分) Na2S+2H2O S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
(2)阳离子(Na+),钛(或石墨); (2分) (3)4, 正四面体。 (2分)
19.(8分)(1)铝热 (置换)反应(2分) (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+(2分)或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (2分) (4)H2SO4(或HNO3) (2分)
20.(12分)
21.(8分)(1) 3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2分)
(2)16 g (2分) (没单位扣1分) (3)0.1 mol (2分)(没单位扣1分)
(4)0.05<n<0.15(2分)
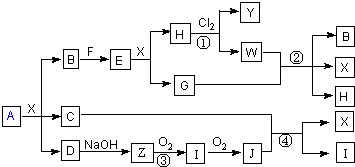
回答下列问题:
(1)组成A的两种盐的化学式为
(2)写出①的离子方程式
(3)写出②的离子方程式
(4)写出③的化学反应方程式
| ||
| ||
(5)写出④的化学反应方程式
(6)写出实验室检验D中阳离子的操作和现象.
(7)将Y溶液滴入沸水可得到红褐色液体,反应的离子方程式是:
| ||
| ||
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入稀硫酸溶液,先有沉淀产生,后沉淀溶解
d.将该液体加热、蒸干、灼烧后,有氢氧化物生成.
下列离子方程式正确的是
A.足量氯气通入溴化亚铁溶液中:2Fe2++Cl2====2Cl-+2Fe3+
B.三氯化铁溶液中滴入碘化钾溶液:Fe3++2I-====Fe2++I2
C.氯化铜溶液中加入铁:Fe+Cu2+====Fe3++Cu
D.H2S通入FeCl3溶液中:H2S+2Fe3+====2Fe2++S↓+2H+
查看习题详情和答案>>A.Fe2(SO4)3+S2-===2FeSO4+S↓+![]()
B.2Fe3++S2-===2Fe2++S↓
C.Fe3++H2S===Fe2++S↓+2H+
D.2Fe3++H2S===2Fe2++S↓+2H+
查看习题详情和答案>>(1)铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入铜屑可以逐渐溶解,该反应的离子方程式:
(2)脱去天然气中的硫化氢既能减少环境污染,又可回收硫资源.其中硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为:
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应