2009届山东省枣庄市高三第一学期期末检测试卷
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷100分。考试时间100分钟。
第Ⅰ卷(选择题 共44分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、考号、考试科目、试卷类型(A或B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,将答题卡和第II卷一并交回。
可能用到的相对原子质量:H
一、选择题(本题包括10小题,每小是与此同时分, 共20分。每小题只有一个选项符合题意。)
1.用如右图表示的一些物质或概念间的从属关系中不正确的是 ( )
X
Y
|

 TiO2、
TiO2、 TiO2、、
TiO2、、 TiO2互为同位素
TiO2互为同位素 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子 11.在恒容密闭容器中A(g)+3B(g)
11.在恒容密闭容器中A(g)+3B(g) 




 CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO(g)+H2O(g) CO2(g)+H2(g) △H<0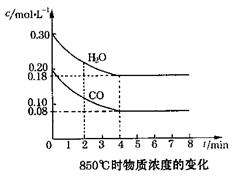
 (1)A(g)+2B(g) C(g)+D(g) △H=-410kJ?mol-1(3分。状态、可逆符号、△H的数值、符号、单位有一处错误扣1分,本小题不出现负分。)
(1)A(g)+2B(g) C(g)+D(g) △H=-410kJ?mol-1(3分。状态、可逆符号、△H的数值、符号、单位有一处错误扣1分,本小题不出现负分。)