题目内容
已知阿伏加德罗常数为NA=6×1023mol-1,在如图所示的一闭合电路中,电源电动势E=6V,r=2.5W,R1=3W,R2为滑动变阻器,电极为铂电极,烧杯中盛有NaC13×10-3mol,H2S041×10-3mol和足量水,电解池内阻r′=9W.求: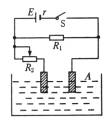
(1)当电源输出功率最大时,R2为多少欧姆?
(2)当溶液pH=7时,R1和R2共消耗电能多少焦耳?
(3)在40min内,电解溶液产生的是什么气体,各为多少摩尔?
答案:
解析:
提示:
解析:
提示:
| 提示:(2)由于溶液中各离子的放电顺序不同,整个过程可分为两个阶段:一是可看作电解HCl,溶液c(H+)减小,pH上升至pH=7,溶液呈中性;二是可看作电解NaCl,生成NaOH,使溶液中c(OH-)增大,pH上升,c(Cl-)完全转化为C12,即电解水.由于pH=7,故H2S04中的H+恰好完全释放,通过的电子为2×10-3mol,Q=192C.由外电路得I1= (3)40min内,可知C1-1全转化为Cl2,H+全转化为H2,及一部分水电解生成OH-和H2、O2,由各化学方程式的比例关系可得:Cl21.5×10-3mol,H22.5×10-3 mol,O25×10-4m0l.
|

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
已知阿伏加德罗常数为N,某物质的摩尔质量为Mkg/mol,该物质的密度为ρkg/m3,则下列叙述中正确的是( )
| A、1kg该物质所含的分子个数是ρ?N | ||
B、1kg该物质所含的分子个数是
| ||
C、该物质1个分子的质量是
| ||
D、该物质1个分子占有的空间是
|
 (1)将一定质量的二氧化碳气体封闭在一可自由压缩的导热容器中,将容器缓慢移到海水某深处.实验发现,在水深300m处,二氧化碳将变成凝胶状态,当水深超过2500m时,二氧化碳会浓缩成近似固体的硬胶体.设在某状态下二氧化碳气体的密度为ρ,摩尔质量为M,阿伏加德罗常数为N,将二氧化碳分子看作直径为D的球,体积为
(1)将一定质量的二氧化碳气体封闭在一可自由压缩的导热容器中,将容器缓慢移到海水某深处.实验发现,在水深300m处,二氧化碳将变成凝胶状态,当水深超过2500m时,二氧化碳会浓缩成近似固体的硬胶体.设在某状态下二氧化碳气体的密度为ρ,摩尔质量为M,阿伏加德罗常数为N,将二氧化碳分子看作直径为D的球,体积为