题目内容
14.(1)已知水的摩尔质量为18g/mol,密度为1.0×103kg/m3,阿伏加德罗常数为6.02×1023mol-1,则一个水分子的质量为多少?(2)若金刚石的密度为3.5×103kg/m3,在一块体积是6.4×10-8m3的金刚石内含有多少个碳原子?(碳的摩尔质量是12g/mol)
(3)已知标准状态下水蒸气的摩尔体积是22.4L/mol,试求在标准状态下水蒸气分子间的距离大约是水分子直径的多少倍?(以上结果均保留两位有效数字)
分析 (1)根据水的摩尔质量和阿伏伽德罗常数求出一个水分子的质量.
(2)根据金刚石的体积求出金刚石的质量,从而得出金刚石的物质量,求出含有的碳原子个数.
(3)根据水蒸气的摩尔体积得出一个分子所占的体积,从求出分子间的距离,得出水蒸气分子间的距离大约是水分子直径的倍数.
解答 解:(1)一个水分子的质量为:
${m}_{0}=\frac{M}{{N}_{A}}=\frac{18}{6.02×1{0}^{23}}$g=3.0×10-23g.
(2)在一块体积是6.4×10-8m3的金刚石内含有的碳原子个数为:
N=$\frac{ρV}{M}{N}_{A}=\frac{3.5×1{0}^{3}×6.4×1{0}^{-8}}{12×1{0}^{-3}}×6.02×1{0}^{23}$≈1.1×1022个.
(3)在标准状态下水蒸气分子所占的体积为:
${V}_{0}=\frac{V}{{N}_{A}}$,又${V}_{0}={a}^{3}$,
则分子间的距离为:a=$\root{3}{\frac{V}{{N}_{A}}}=\root{3}{\frac{22.4×1{0}^{-3}}{6.02×1{0}^{23}}}$m=0.72×10-3,
可知标准状态下水蒸气分子间的距离大约是水分子直径的倍数大约为$\frac{0.72×1{0}^{-3}}{1{0}^{-10}}$=7.2×106倍.
答:(1)一个水分子的质量为3.0×10-23g.
(2)在一块体积是6.4×10-8m3的金刚石内含有1.1×1022个.
(3)在标准状态下水蒸气分子间的距离大约是水分子直径的7.2×106倍.
点评 解决本题的关键知道质量、体积、密度、摩尔质量、物质的量、分子数之间的关系,知道阿伏伽德罗常数是联系宏观物理量和微观物理量之间的桥梁.

 中考解读考点精练系列答案
中考解读考点精练系列答案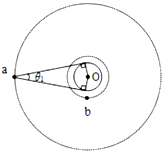 我国的“天链一号”卫星是地球同步卫星,可为中低轨道卫星提供数据通讯,如图为“天链一号”卫星a、赤道平面内的低轨道卫星b、地球的位置关系示意图,O为地心,地球相对卫星a、b的张角分别为θ1和θ2(θ2图中未标出),卫星a的轨道半径是b的4倍,己知卫星a、b绕地球同向运行,卫星a的周期为T,在运行过程中由于地球的遮挡,卫星b会进入卫星a通讯的盲区,卫星间的通讯信号视为沿直线传播,信号传输时间可忽略.下列分析正确的是( )
我国的“天链一号”卫星是地球同步卫星,可为中低轨道卫星提供数据通讯,如图为“天链一号”卫星a、赤道平面内的低轨道卫星b、地球的位置关系示意图,O为地心,地球相对卫星a、b的张角分别为θ1和θ2(θ2图中未标出),卫星a的轨道半径是b的4倍,己知卫星a、b绕地球同向运行,卫星a的周期为T,在运行过程中由于地球的遮挡,卫星b会进入卫星a通讯的盲区,卫星间的通讯信号视为沿直线传播,信号传输时间可忽略.下列分析正确的是( )| A. | 卫星a,b的速度之比2:1 | |
| B. | 卫星b星的周期为$\frac{T}{8}$ | |
| C. | 卫星b每次在盲区运行的时间为$\frac{{θ}_{1}+{θ}_{2}}{14π}$T | |
| D. | 卫星b每次在盲区运行的时间为$\frac{{θ}_{1}+{θ}_{2}}{16π}$T |
| A. | 在地球周围作匀速圆周运动的人造卫星的线速度都等于7.9 km/s | |
| B. | 发射速度大于7.9 km/s的人造地球卫星进入轨道后的线速度一定大于7.9 km/s | |
| C. | 卫星受阻力作用轨道半径缓慢减小后,其线速度将变大 | |
| D. | 由v=$\sqrt{\frac{GM}{R}}$可知,离地面越高的卫星其发射速度越小 |
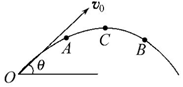 如图是做斜抛运动物体的轨迹,C点是轨迹的最高点,AB是轨迹上等高的两个点.下列叙述中正确的是(不计空气阻力)( )
如图是做斜抛运动物体的轨迹,C点是轨迹的最高点,AB是轨迹上等高的两个点.下列叙述中正确的是(不计空气阻力)( )| A. | 物体在C点速度为零 | |
| B. | 物体在A点速度与物体在B点速度相同 | |
| C. | 物体在A点、B点的水平速度均大于物体在C点的速度 | |
| D. | 物体在A、B、C各点的加速度都相同 |
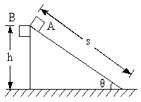 如图所示,质量相同的两物体处于同一高度,A沿固定在地面上的光滑斜面下滑,B自由下落,最后到达同一水平面,则( )
如图所示,质量相同的两物体处于同一高度,A沿固定在地面上的光滑斜面下滑,B自由下落,最后到达同一水平面,则( )| A. | 两物体刚到达底端时的速度相同 | |
| B. | 刚到达底端时重力的瞬时功率PA=PB | |
| C. | 若斜面粗糙,A对斜面的摩擦力对斜面不做功 | |
| D. | 若斜面粗糙,斜面对A的摩擦力对A做负功 |
 如图所示,生产车间有两个相互垂直且等高的水平传送带甲和乙,甲的速度为v0,小工件离开甲前与甲的速度相同,并平稳地传到乙上,工件与乙之间的动摩擦因数为μ.乙的宽度足够大,重力加速度为g,则( )
如图所示,生产车间有两个相互垂直且等高的水平传送带甲和乙,甲的速度为v0,小工件离开甲前与甲的速度相同,并平稳地传到乙上,工件与乙之间的动摩擦因数为μ.乙的宽度足够大,重力加速度为g,则( )| A. | 若乙的速度为 v0,工件在乙上侧向( 垂直于乙的运动方向)滑过的距离s=$\frac{{{v}_{0}}^{2}}{2gμ}$ | |
| B. | 若乙的速度为 2v0,工件从滑上乙到在乙上侧向滑动停止所用的时间不变 | |
| C. | 若乙的速度为 2v0,工件在乙上刚停止侧向滑动时的速度大小v=2v0 | |
| D. | 保持乙的速度 2v0 不变,当工件在乙上刚停止滑动时,下一只工件恰好传到乙上,如此反复.若每个工件的质量均为m,除工件与传送带之间摩擦外,其他能量损耗均不计,驱动乙的电动机的平均输出功率$\overline{P}$=$\frac{4\sqrt{5}}{5}$mgμv0 |
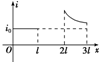
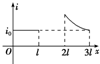
 如图所示,abcd为一边长为l、具有质量的刚性导线框,位于水平面内,bc边串接有电阻R.虚线表示一匀强磁场区域的边界,它与线框ab边平行,磁场区域的宽度为2l,磁场方向竖直向下.线框在一垂直于ab边的水平恒定拉力F作用下,沿光滑水平面运动,直到通过磁场区域.已知ab边刚进入磁场时,线框做匀速运动,下面定性画出的回路中电流i大小与位移x图象一定错误的是( )
如图所示,abcd为一边长为l、具有质量的刚性导线框,位于水平面内,bc边串接有电阻R.虚线表示一匀强磁场区域的边界,它与线框ab边平行,磁场区域的宽度为2l,磁场方向竖直向下.线框在一垂直于ab边的水平恒定拉力F作用下,沿光滑水平面运动,直到通过磁场区域.已知ab边刚进入磁场时,线框做匀速运动,下面定性画出的回路中电流i大小与位移x图象一定错误的是( )

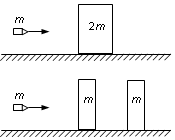 质量为2m、厚度为2d的钢板静止在水平光滑桌面上.质量为m的子弹以某一速度垂直射向该钢板,刚好能将钢板射穿.现把钢板分成厚度均为d、质量均为m的相同两块,间隔一段距离水平放置,如图所示.若子弹以相同的速度V0垂直射向第一块钢板,穿出后再射向第二块钢板.(设子弹在钢板中受到的阻力为恒力,且两块钢板不会发生碰撞.不计重力影响)求:
质量为2m、厚度为2d的钢板静止在水平光滑桌面上.质量为m的子弹以某一速度垂直射向该钢板,刚好能将钢板射穿.现把钢板分成厚度均为d、质量均为m的相同两块,间隔一段距离水平放置,如图所示.若子弹以相同的速度V0垂直射向第一块钢板,穿出后再射向第二块钢板.(设子弹在钢板中受到的阻力为恒力,且两块钢板不会发生碰撞.不计重力影响)求: 如图所示,虚线MN右侧存在一个竖直向上的匀强磁场,一边长为L的正方形单匝均匀金属线框abcd放在光滑水平面上,电阻为R,质量为m,ab边在磁场外侧紧靠MN虚线边界.t=0时起磁感应强度B随时间t的变化规律是B=λt(λ为大于零的常数),同时用一水平外力使线圈处于静止状态,空气阻力忽略不计.
如图所示,虚线MN右侧存在一个竖直向上的匀强磁场,一边长为L的正方形单匝均匀金属线框abcd放在光滑水平面上,电阻为R,质量为m,ab边在磁场外侧紧靠MN虚线边界.t=0时起磁感应强度B随时间t的变化规律是B=λt(λ为大于零的常数),同时用一水平外力使线圈处于静止状态,空气阻力忽略不计.