��Ŀ����
����Ŀ�����ᶡ������Ҫ�Ļ���ԭ�ϣ�����ˮ����ζ��ʵ�����Ʊ����ᶡ���ķ�Ӧ��װ��ʾ��ͼ���й���Ϣ���£�
CH3COOH��CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3��H2O
CH3COOCH2CH2CH2CH3��H2O
���� | ������ | ���ᶡ�� | |
�۵�/�� | 16.6 | ��89.5 | ��73.5 |
�е�/�� | 117.9 | 117 | 126.0 |
�ܶ�/g��cm��3 | 1.1 | 0.80 | 0.88 |
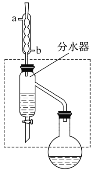
��1�����ᶡ���ֲ�Ʒ���Ʊ�
�ڸ����50 mLԲ����ƿ�У�װ���ʯ������12.0 mL��������16.0 mL������(����)���ټ�3��4��Ũ���ᡣȻ���ٰ�װ��ˮ��(���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ)�������ܣ�Ȼ��С����ȡ�����ƿ�з�Ӧ��Ļ������ȴ���ˮ��������ϲ���װ������ˮӦ��________(����a������b��)��ͨ�룻ͨ����ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��Ŀ����___________________________________________________��
��2�����ᶡ���ľ���
�����ᶡ���ֲ�Ʒ�����µIJ������о��ƣ���ˮϴ��������������ˮMgSO4�������10%̼����ϴ�ӡ�
����ȷ�IJ���������________________(����)��
A���٢ڢۢ� B���ۢ٢ܢ� C���ܢ٢ۢ� D���ۢܢ٢�
�������ᶡ���ľ����У���10%̼����ϴ�ӵ���ҪĿ���� ��
����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ��________(����)��
A��ֱ�ӽ����ᶡ���ӷ�Һ©�����Ͽڵ���
B��ֱ�ӽ����ᶡ���ӷ�Һ©�����¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ᶡ�����¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ᶡ�����Ͽڵ���
��3���������
������ˮ�����������붡����Ӧ���ɵ�ˮ���Ϊ1.8 mL����������ȡ���ᶡ�������з�Ӧ���������û����ʧ���Һ��Ը���Ӧ�����ᶡ���IJ���Ϊ________��
���𰸡���1��b���������ɵ�ˮ��ʹƽ�������ƶ�����߷�Ӧ����
��2����C
��ϴ��Ũ�������������
��d
��3��77.1%
��������
�����������1��Ϊ�˱�֤�������г���ˮ��Ӧ��b��ˮ���ᴼ��Ӧ��������ˮ���������ɵ�ˮ��ʹƽ�������ƶ�����߷�Ӧ���ʡ���2���������������к���������Ҵ�Ũ��������ʣ��ȼ���̼�����ܽ��Ҵ�����Ӧ���ᣬ��ˮϴ���������þ�������ѡC��������̼������Һ��ϴ��Ũ������������ᡣ�����ᶡ���IJ�����ˮ���ܶȱ�ˮС�������ȴ��¿ڷų�ˮ��Һ���ٴ��Ͽڵ������ᶡ����ѡd����3�����������Ϊ16.0��1.1=17.6g��������������Ϊ12.0��0.8=9.6g����˵��������������������������ȫ��Ӧ���������ᶡ�������ʵ���Ϊxmol��74/9.6=1/x����x=9.6/74mol��ˮ������Ϊ18�ˣ����ʵ���Ϊ1mol�������Ϊ1/��9.6/74��=7.4/9.6=77.1%