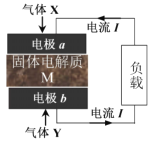
【题目】硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
(1)写出基态Zn原子的价电子排布式__,基态S原子核外未成对电子数为__。
(2)ZnSO4中三种元素的电负性由大到小的顺序为__,SO42-的立体构型为__,其中S的杂化轨道类型为__。
(3)硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有__。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
(4)根据下列锌卤化物的熔点和溶解性,分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因__。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5)钾晶体晶胞结构如图所示,距离最近的两个钾原子距离为acm,阿伏加德罗常数为NA。
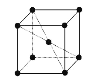
①钾原子核外运动状态不同的电子数是___。
②钾晶体的密度是___。