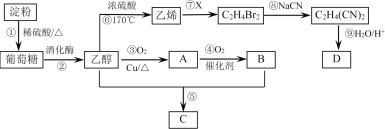
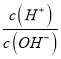题目内容
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况右图所示,回答下列问题。
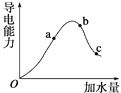
(1)“O”点时液体不能导电,说明醋酸中________离子键(填“含有”或“不含”)。
(2)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(3)要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的两种措施是______________。
(4)若实验测得c点处溶液中c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________。
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是________________
A.c(H+) B.H+个数
C.CH3COOH分子数 D.![]()
【答案】 不含 c>b>a b 加入锌、NaOH或CH3COONa(其他合理答案也可) 1×10-5 BD
【解析】(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸为共价化合物,不存在离子键,则没有自由移动的离子,所以冰醋酸不导电,故答案为:不含;
(2)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,根据图像知,水的体积越大,溶液的浓度越小,醋酸的电离程度越大,所以醋酸电离程度大小顺序是c>b>a;溶液的导电能力与离子浓度成正比,所以溶液导电能力越大氢离子浓度越大,则氢离子浓度最大的为b,故答案为:c>b>a;b;
(3)要使醋酸根离子浓度增大,c(H+)减少,可以采用消耗氢离子的方法使电离平衡向正方向移动,故可以加入Zn,NaOH等;或者增加醋酸根浓度使电离向逆方向移动,故可加CH3COONa等,故答案为:加入Zn,NaOH或CH3COONa;
(4)经实验测得C点处:c(CH3COOH)=0.1molL-1,c(CH3COO-)=0.001molL-1,则该条件下CH3COOH的电离常数Ka=![]() =1.0×10-5,故答案为:1.0×10-5;
=1.0×10-5,故答案为:1.0×10-5;
(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,故A错误;B.弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;C.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;D.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则c(H+)/c(CH3COOH)增大,故D正确;故答案为:BD。

【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |

A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)