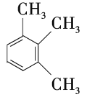
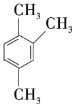
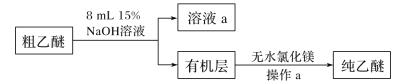
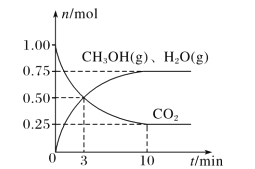
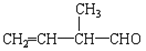【题目】工业上常用绿柱石(主要成分3BeOAl2O36SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
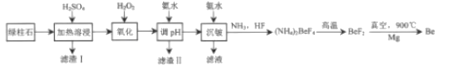
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
Be2+ | Al3+ | Fe3+ | Fe2+ | |
开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
回答下列问题:
(1)滤渣Ⅰ的主要成分是______,加入H2O2的作用是______。
(2)得到滤渣Ⅱ的合理pH范围是______。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______。
(4)得到(NH4)2BeF4的化学方程式为______。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______。(用含a、b的表达式表示)
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
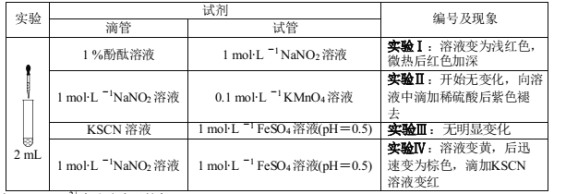
资料:[Fe(NO)] 2+在溶液中呈棕色。
(1)结合化学用语解释实验Ⅰ“微热后红色加深”的原因 ___;
(2)实验Ⅱ证明NO2-具有 ____性;
(3)实验Ⅳ证明NO2-具有_____性;写出此反应溶液先变黄后变成棕色的离子反应方程式 ____;
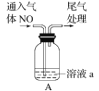
(4)探究实验Ⅳ中的棕色溶液
①为确定棕色物质是NO 与 Fe2+ 而非与 Fe3+ 发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 现象 |
| 1mol/LFeSO4溶液(pH=0.5) | 溶液由________色迅速变为____色 |
__________________ | 无明显变化 |
②加热实验Ⅳ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因 ___ 。