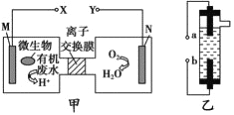
【题目】某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置 | 编号 | 试剂X | 实验现象 |
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
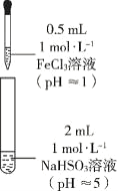
(1)怎样配制FeCl3溶液? ________________________________________________________。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
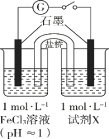
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置 | 编号 | 反应时间 | 实验现象 |
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3-![]() Fe(OH)3 +3SO2;②_____________________________________________。
Fe(OH)3 +3SO2;②_____________________________________________。
![]()
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________。
(实验反思)
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________有关(写出两条)。
【题目】某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息:
I2 | 紫黑色晶体,沸点184.3°C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 |
CCl4 | 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 |
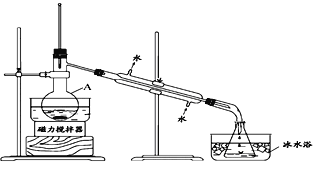
I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验:
(1)该装置中仪器A的名称是____________。
(2)锥形瓶置于冰水中的目的是_____________。
(3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。
①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏
II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验:
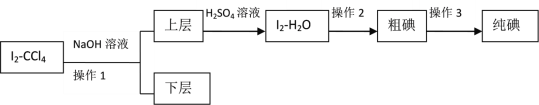
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名称是____________。
(5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。
(6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________