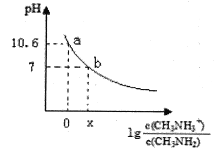
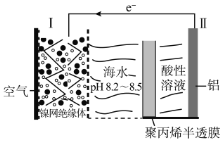
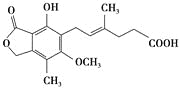
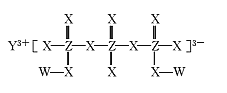【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。
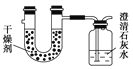
实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。