【题目】近年来,汽车尾气催化净化成为极其重要的环保产业。请回答下列问题:
I.治理汽车尾气中NO和CO的一种方法是在汽车的排气管道上安装一个催化转化装置。发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
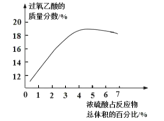
(1)实际测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图一,0~10 s阶段,CO、NO百分含量没有明显变化的原因是______;

(2)在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图二。
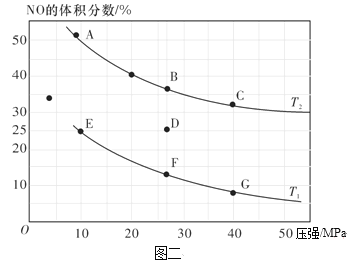
①已知T2>T1,则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
②为同时提高反应速率和NO的平衡转化率,可采取的措施有______(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积
c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,该温度下用分压表示的平衡常数Kp=___MPa-1(分压=总压×物质的量分数)。
II.汽车尾气中CO与N2O会发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/ kJ/mol | 475.5 | 283 | 0 | 393.5 |
(3)ΔH=___kJ/mol。
(4)实验室用Fe+作催化剂,以N2O和CO投入比为1:1模拟上述反应,其总反应分两步进行:
第一步:Fe++N2O![]() FeO++N2;
FeO++N2;
第二步:___(写反应方程式)。
催化过程中,c(N2)和c(CO2)几乎相等,由此判断该反应进行的快慢由第___步反应决定。
请在如图中绘制反应在催化剂作用下的“能量~反应过程”示意图___。已知:两步反应均放热。
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程。
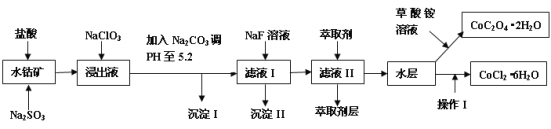
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的离子方程式为___。
(2)在浸出液中加入NaClO3的作用是___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀II的主要成分___。
(4)操作I中包括蒸发浓缩的过程,在蒸发浓缩之前应先向溶液中加入_______(填试剂名称)。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥、称重。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49 g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则在150℃~210℃温度范围放出的气体物质是_______,290℃~320℃温度范围,剩余的固体物质化学式为________。
[已知:CoC2O4·2H2O的摩尔质量为183 g/mol]