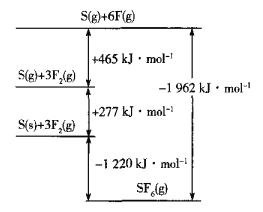
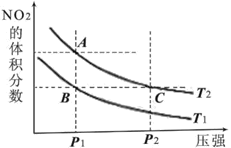
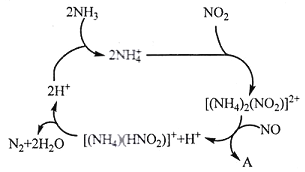
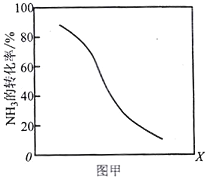
0 202503 202511 202517 202521 202527 202529 202533 202539 202541 202547 202553 202557 202559 202563 202569 202571 202577 202581 202583 202587 202589 202593 202595 202597 202598 202599 202601 202602 202603 202605 202607 202611 202613 202617 202619 202623 202629 202631 202637 202641 202643 202647 202653 202659 202661 202667 202671 202673 202679 202683 202689 202697 203614