题目内容
【题目】在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
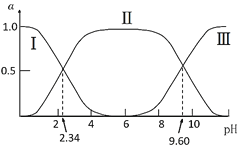
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A、A±、A+
B.K2=102.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A)
【答案】C
【解析】
A.根据其解离情况可知:溶液碱性越强,A-含量越大,溶液酸性越强,A+含量越大,故曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A+、A±、A-,A错误;
B.由图可知pH=9.60时,溶液中H3N+CH2COO-与H2NCH2COO-浓度相等,K2对应的解离过程为:H3N+CH2COO-![]() H2NCH2COO-+H+,K2=
H2NCH2COO-+H+,K2= =10-9.60,K2对应的解离基团为COO-,B错误;
=10-9.60,K2对应的解离基团为COO-,B错误;
C.根据物料守恒可知,α(A±)+α(A+)+α(A-)保持不变,C正确;
D.由图可知,等电点pH约为6,此时溶液中c(H3N+CH2COO-)>c(H3N+CH2COOH)=c(H2NCH2COO-),D错误;
故合理选项是C。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】下表中有关变化和反应的对应关系正确的是( )
A | 蒸馏;干馏 | 均为物理变化 |
B | 2FeCl3+Cu=2FeCl2+CuCl2; SiO2+2C | 均为置换反应 |
C | Cl2通入品红溶液中,品红褪色;木炭加入品红溶液中,振荡,褪色 | 前者为化学变化,后者为物理变化 |
D | 在沸水中滴加饱和FeCl3溶液;在CuCl2溶液中滴加NaOH溶液 | 均为生成沉淀的复分解反应 |
A.AB.BC.CD.D