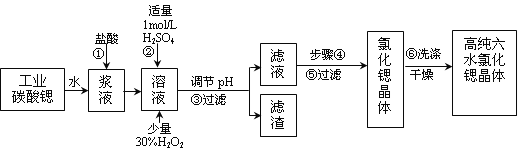
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和____________________(写一种)。碳酸锶与盐酸反应的离子方程式________________________________。
(2)在步骤②~③的过程中,将溶液的pH值由1调节至_______;宜用的试剂为_______。
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_______________________(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是_______。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_______________。
【题目】为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下2L的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s | 0 | 500 | 1000 |
c(H2)/ mol.L-1 | 5.00 | 3.52 | 2.48 |
c(CO)/ mol.L-1 | 2.50 |
(1)在500s内用H2表示的化学反应速率是________________。
(2)在1000s内用CO表示的化学反应速率是________________,1000s时CO的转化率是________。
(3)在500s时生成的甲醇的浓度是________
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
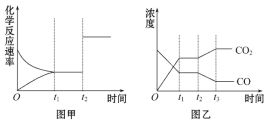
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
【题目】现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 硫酸 |
pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g) + Y(g) ![]() 2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2Z(g) H<0,一段时间后达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10–5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大