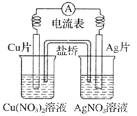
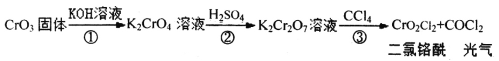
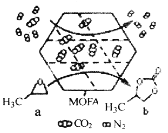
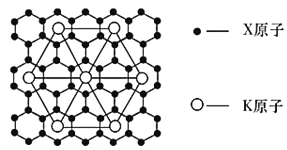
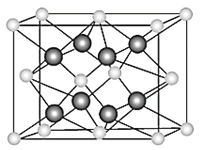
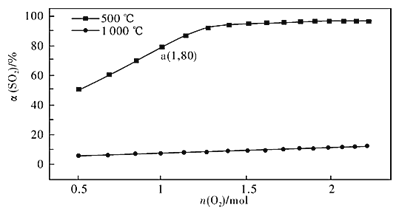
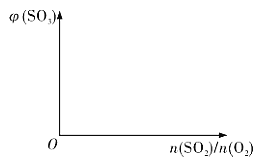
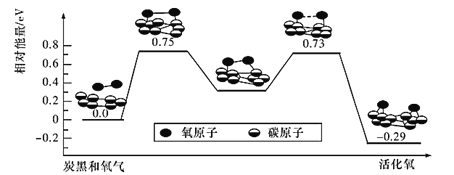
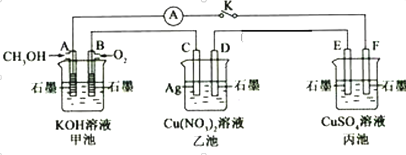
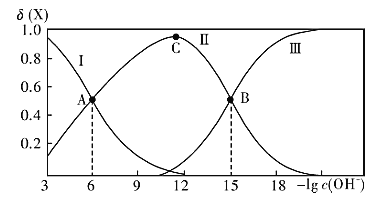
0 202288 202296 202302 202306 202312 202314 202318 202324 202326 202332 202338 202342 202344 202348 202354 202356 202362 202366 202368 202372 202374 202378 202380 202382 202383 202384 202386 202387 202388 202390 202392 202396 202398 202402 202404 202408 202414 202416 202422 202426 202428 202432 202438 202444 202446 202452 202456 202458 202464 202468 202474 202482 203614