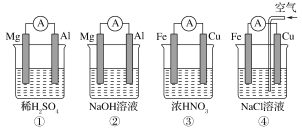
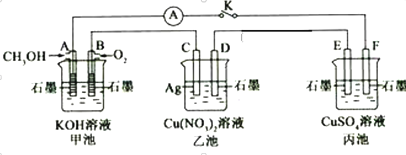
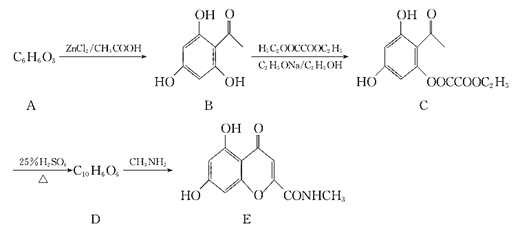
题目内容
【题目】交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示。下列判断正确的是
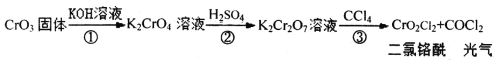
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
【答案】A
【解析】
A.酸性氧化物能与碱反应生成盐和水,CrO3与KOH溶液反应生成盐和水,则CrO3是酸性氧化物,故A正确;
B.CrO42-与酸反应,与碱不反应,所以CrO42-在碱性溶液中能大量存在,故B错误;
C.反应③中没有元素化合价的变化,不是氧化还原反应,故C错误;
D.电子排布处于全满或半满状态是稳定状态,则基态铬原子的价电子排布式为3d54s1,故D错误。
故选:A。

 名校课堂系列答案
名校课堂系列答案【题目】电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________(填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
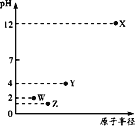
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
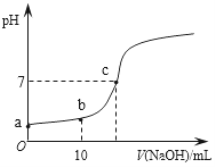
(6)a点溶液pH > 1,用电离方程式解释原因:_____________。
(7)下列有关b点溶液的说法正确的是_______(填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________。
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动