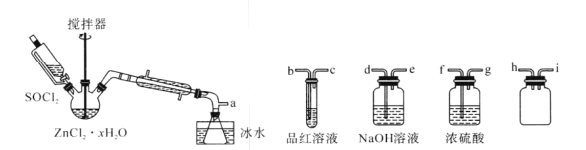
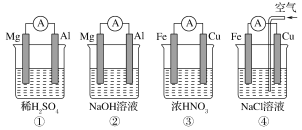
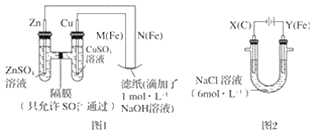
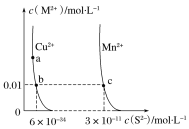
0 202285 202293 202299 202303 202309 202311 202315 202321 202323 202329 202335 202339 202341 202345 202351 202353 202359 202363 202365 202369 202371 202375 202377 202379 202380 202381 202383 202384 202385 202387 202389 202393 202395 202399 202401 202405 202411 202413 202419 202423 202425 202429 202435 202441 202443 202449 202453 202455 202461 202465 202471 202479 203614