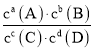��Ŀ����
����Ŀ���Ͼɵ���е�Zn��MnԪ�صĻ��գ��Ի�����������Ҫ�����塣п�̸ɵ�صĸ�������Ϊ��ؿ���Ľ���п�������DZ��������̺�̼�۰�Χ��ʯī�缫����������Ȼ�п���Ȼ�淋ĺ�״��õ�طŵ�����в���MnOOH��
I.����пԪ�أ��Ʊ�ZnCl2
����һ�����ȥ���弰ʯī�缫�ĺ�ɫ��״���м�ˮ�����裬����ܽ⣬�����˷���ù������Һ��
�������������Һ���õ�ZnCl2��xH2O���壻
����������SOCl2��ZnCl2��xH2O��������ȡ��ˮZnCl2��
��ȡ��ˮZnCl2������ʣ���SOCl2����֤�������к���SO2(�гּ�����װ����)��װ�����£�
��֪��SOCl2��һ�ֳ��õ���ˮ�����۵�-105�棬�е�79�棬140������ʱ�ֽ⣬��ˮ����ˮ�������������塣
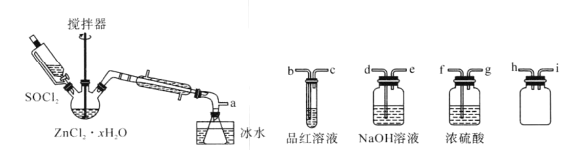
��1���ӿڵ�����˳��Ϊa��___��____��h��i��___��___��___��e��
��2��������ƿ�з�Ӧ�Ļ�ѧ����ʽ��____��
��3��������еõ�ZnCl2��xH2O����IJ���������___��
��4����֤�������к���SO2������Ϊ��___��
II.������Ԫ�أ��Ʊ�MnO2
��5������һ�õ��Ĺ��徭ϴ�ӣ��������ɺ�������գ����յ�Ŀ��____��
III.�������̴��ȵIJⶨ
��ȡ1.0g���պ�IJ�Ʒ������1.34g������(Na2C2O4)���壬�ټ���������ϡ���Ტ����(���ʲ����뷴Ӧ)����ַ�Ӧ����ȴ����������Һת�Ƶ�100mL����ƿ��������ˮϡ�����̶��ߣ�����ȡ��10.00mL����0.0200mol/L���������Һ���еζ����ζ����Σ����ĸ��������Һ�����ƽ��ֵΪ10.00mL��
��6��д��MnO2�ܽⷴӦ�����ӷ���ʽ___��
��7����Ʒ�Ĵ���Ϊ____��
���𰸡�f g b c d xSOCl2+ZnCl2��xH2O=xSO2��+2xHCl��+ ZnCl2 ����Ũ������ȴ�ᾧ������ Ʒ����Һ��ɫ ��ȥ̼�ۣ�����MnOOH����ΪMnO2 MnO2+C2O42-+4H+![]() Mn2++2CO2��+2H2O 43.5%
Mn2++2CO2��+2H2O 43.5%
��������
����SOCl2���սᾧˮ�õ�SO2��HCl���ñ�ˮ��ȴ�ռ�SOCl2��Ũ��������ˮ��������ֹ��Һ��ˮ�������룬��Ʒ����Һ�����������������������Һ����β���ֶ���������HCl����ֹ��Ⱦ������ע���ֹ������
III.�õζ�ʵ���ԭ��Ϊ���ø�����ر�Һ���ⶨδ��Ӧ�IJ�����������Ӷ�ȷ����������Ӧ�Ķ������̵�����
������1�����ݷ�����֪װ�õ�����˳��Ϊf��g��h��i��b��c��d��e��
��2��������ƿ��ΪSOCl2��ZnCl2��xH2O�еĽᾧˮ�ķ�Ӧ��SOCl2��ˮ���ҷ�Ӧ����SO2��HCl�����Է�Ӧ����ʽΪ��xSOCl2+ZnCl2��xH2O=xSO2��+2xHCl��+ ZnCl2��
��3������Һ�õ����壬�ɽ�������Ũ������ȴ�ᾧ�����ˣ�
��4�����������ʹƷ����Һ��ɫ�����Ե����������ж�������ʱ��۲쵽Ʒ����Һ��ɫ��
II. ��5�����庬��̼��MnOOH�����տ����ɶ�����̼���Գ�ȥ̼���ҽ�MnOOH����ΪMnO2���ʴ�Ϊ����ȥ̼�ۣ�����MnOOH����ΪMnO2��
III.��6��MnO2�ܽ��ڲ������У��������̻Ὣ����������õ������ӺͶ�����̼����ϵ���غ�������غ���д�ɵ����ӷ���ʽΪ��MnO2+C2O42-+4H+=Mn2++2CO2��+2H2O��
��7��������������Ի�����Ҳ���Խ��������������Ӧ����ʽΪ2MnO4-+5C2O42-+16H+=2Mn2++10CO2��+8H2O�����ݷ���ʽ��֪����������ϵ��2MnO4-~5C2O42-����10.00mL����Һ��ʣ���n��C2O42-��=0.0200mol/L��0.01L��![]() =0.0005mol������ʣ���n��C2O42-��=0.0005mol��
=0.0005mol������ʣ���n��C2O42-��=0.0005mol��![]() =0.005mol���ܵIJ���������ʵ���Ϊ
=0.005mol���ܵIJ���������ʵ���Ϊ![]() =0.01mol������������̷�Ӧ��n��C2O42-��=0.01mol-0.005mol=0.005mol�����ݷ�Ӧ����ʽMnO2+C2O42-+4H+=Mn2++2CO2��+2H2O��֪n(MnO2)=0.005mol�����Բ�Ʒ�Ĵ���Ϊ
=0.01mol������������̷�Ӧ��n��C2O42-��=0.01mol-0.005mol=0.005mol�����ݷ�Ӧ����ʽMnO2+C2O42-+4H+=Mn2++2CO2��+2H2O��֪n(MnO2)=0.005mol�����Բ�Ʒ�Ĵ���Ϊ![]()

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������������(V2O5)��ұ���´ɡ����Բ��ϵ����������Ҫ��Ӧ�á�ʵ�����Ժ�������(����V2O3��CuO��MnO��SiO2���л���)Ϊԭ���Ʊ�V2O5�Ĺ���������ͼ��ʾ��

��֪����.������������Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���ʾ��
pH | 4��6 | 6��8 | 8��10 | 10��12 |
��Ҫ������ʽ | VO2+ | VO3- | V2O74- | VO43- |
��.25��ʱ���������ܵ���ʵ��ܶȻ��������±���ʾ��
���ܵ���� | Cu(OH)2 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 4.8��10-20 | 4��10-14 |
��.25��ʱ��NH4VO3���ܽ��Ϊ0.4gL-1��70��ʱ��NH4VO3���ܽ��Ϊ63gL-1��
��ش��������⣺
��1������������Ŀ����___��
��2������1����;Ϊ___(��дһ��)��
��3������pH����Ŀ�ij���ʹCu2+������ȫ�⣬����___������pHΪ7ʱ��Cu2+�Ƿ������ȫ��___��(д��������̣�����Һ������Ũ��С��10-5molL-1ʱ����Ϊ�����ӳ�����ȫ)
��4����������ʱ���轫�¶ȿ�����70�����ң��¶Ȳ��ܹ�����͵�ԭ��Ϊ___��
��5����Ũ���ᾧ�����������NH4VO3����ϴ�ӡ����ϴ�Ӽ���ѡ��___��֤��NH4VO3��ϴ�Ӹɾ���ʵ�����������Ϊ___��
��6����������ʱ����������Ⱦ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ___��