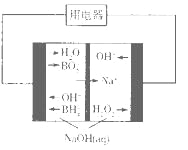
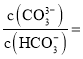【题目】下列根据实验现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液X中加入少量铁粉,振荡 | 得到澄清溶液 | X中一定不含Cu2+ |
B | 浓度均为0.1molL-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)大于Ksp(Ag2CO3) |
C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
D | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D
【题目】电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________(填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
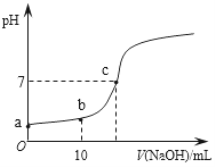
(6)a点溶液pH > 1,用电离方程式解释原因:_____________。
(7)下列有关b点溶液的说法正确的是_______(填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________。
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
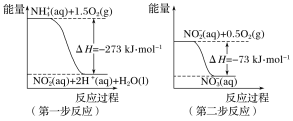
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
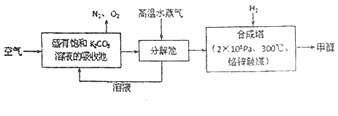
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。