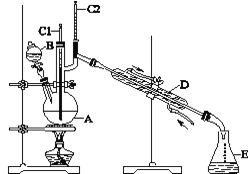
【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛。
发生的反应如下:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为_______。
(2)加入沸石的作用是_____________。若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是___________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
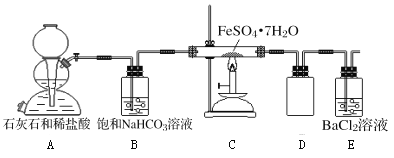
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。
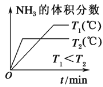
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。

查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
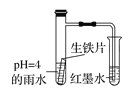
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
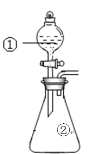
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D