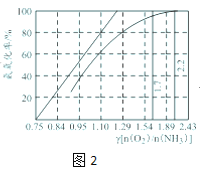
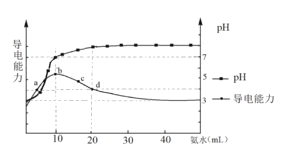
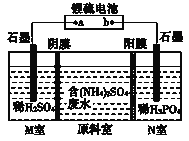
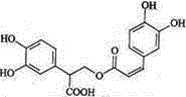
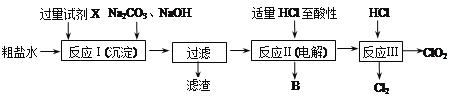
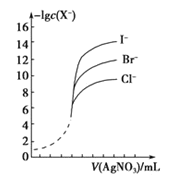
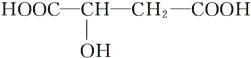0 201611 201619 201625 201629 201635 201637 201641 201647 201649 201655 201661 201665 201667 201671 201677 201679 201685 201689 201691 201695 201697 201701 201703 201705 201706 201707 201709 201710 201711 201713 201715 201719 201721 201725 201727 201731 201737 201739 201745 201749 201751 201755 201761 201767 201769 201775 201779 201781 201787 201791 201797 201805 203614