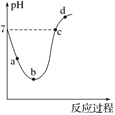
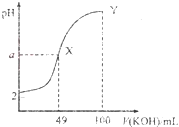
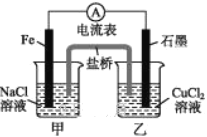
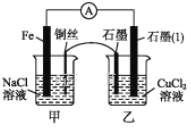
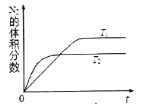
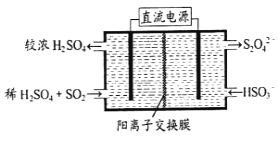
0 201603 201611 201617 201621 201627 201629 201633 201639 201641 201647 201653 201657 201659 201663 201669 201671 201677 201681 201683 201687 201689 201693 201695 201697 201698 201699 201701 201702 201703 201705 201707 201711 201713 201717 201719 201723 201729 201731 201737 201741 201743 201747 201753 201759 201761 201767 201771 201773 201779 201783 201789 201797 203614