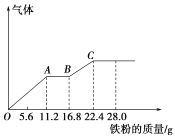
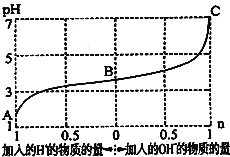
题目内容
【题目】下列叙述不正确的是
A.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中![]()
![]() 的值减小
的值减小
B.中和滴定时,滴定管用所盛装的反应液润洗![]() 次
次
C.浓度均为![]() 的下列溶液,pH由大到小的排列顺序为:
的下列溶液,pH由大到小的排列顺序为:![]()
D.为确定HA是强酸还是弱酸,常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,则HA是弱酸;若
,则HA是弱酸;若![]() ,则HA是强酸
,则HA是强酸
【答案】C
【解析】
A.加水稀释醋酸,促进醋酸电离,但是醋酸电离增大程度小于溶液体积增大程度,所以溶液中![]() 减小,选项A正确;
减小,选项A正确;
B.中和滴定时,滴定管内所盛的反应液应该润洗![]() 次,否则导致溶液浓度降低,测定值偏大,选项B正确;
次,否则导致溶液浓度降低,测定值偏大,选项B正确;
C.NaOH溶液是强碱溶液![]() ;
;![]() 溶液中碳酸根离子水解,溶液呈碱性,
溶液中碳酸根离子水解,溶液呈碱性,![]() ,碱性小于氢氧化钠溶液,
,碱性小于氢氧化钠溶液,![]() 水解程度小于碳酸钠,所以碱性
水解程度小于碳酸钠,所以碱性![]() 大于
大于![]() ,
,![]() 和
和![]() 溶液由于水解显酸性,
溶液由于水解显酸性,![]() 中的c(NH4+)大于NH4Cl中的c(NH4+),所以
中的c(NH4+)大于NH4Cl中的c(NH4+),所以![]() 的酸性大于
的酸性大于![]() ,所以溶液的pH由大到小的排列顺序为:
,所以溶液的pH由大到小的排列顺序为:![]() ,选项C错误;
,选项C错误;
D.常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,说明溶液中
,说明溶液中![]() ,则HA部分电离,所以HA是弱酸;若
,则HA部分电离,所以HA是弱酸;若![]() ,说明溶液中
,说明溶液中![]() ,HA完全电离,则HA是强酸,选项D正确;
,HA完全电离,则HA是强酸,选项D正确;
答案选C。

【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D
【题目】室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
实验 | 操作 | 实验现象 |
Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2)
| 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
Ⅱ |
4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
Ⅲ |
| 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是________,产生原因是_________(用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
实验 | 操作 | 实验现象 |
Ⅳ |
| 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______。残余固体加入浓硝酸时,反应的化学方程式是________。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜(Cu2(OH)2SO4)是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是(Cu2(OH)2SO4);
ii.是Cu(OH)2和(Cu2(OH)2SO4)的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________有关。