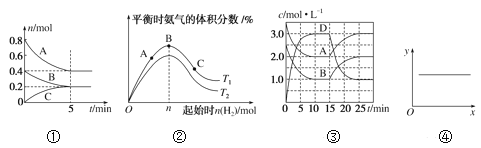
【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
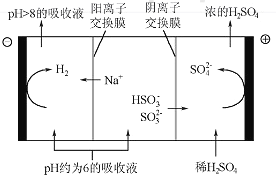
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________