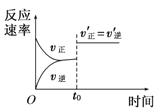
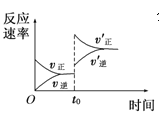
��Ŀ����
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
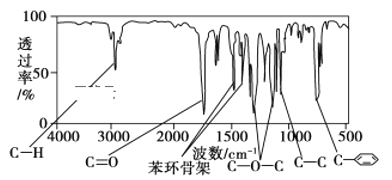
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��______________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��________________________
��3������Һ����SO2�Ĺ����У�pH��n(SO3��):n(HSO3��)�仯��ϵ���±�:
n(SO��)��n(HSO��) | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ��______�ԣ��û�ѧƽ��ԭ�����ͣ�____________��
��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ)��____________
a��c��Na����=2c��SO32-����c��HSO3������
b��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH����
c��c��Na����+c��H����= c��SO32-��+ c��HSO3����+c��OH����
(4)������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�
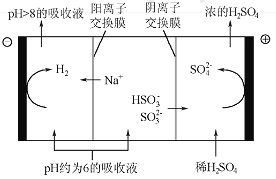
��HSO3-�������ŵ�ĵ缫��Ӧʽ��_______________��
��������������Һp������8����ʱ������Һ������ѭ�����á���������ԭ����__________
���𰸡�SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��
2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
��������
��1��SO2�ڿ����б���������ΪSO3��SO3��ˮ��Ӧ�������ᣬҲ������SO2�Ⱥ�ˮ��Ӧ���������ᣬ�����ᱻ��������Ϊ���ᡣ
��2��������SO2��NaOH��Һ��Ӧ����Na2SO3��
��3������n(SO2-)��n(HSO-)=1:91ʱ��Һ��pH=6.2��֪NaHSO3��Һ�����ԣ�ԭ����HSO-�ĵ���̶ȴ�����ˮ��̶ȡ����ݵ���غ㡢�ͱ������ݿ��ж�Ũ�ȹ�ϵ��
(4)�����У�������HSO-ʧȥ��������SO42-��ͬʱ����H+������ϡ����Ũ��������������ˮ�����H+�õ�����������������Һ��OH-Ũ������HSO-��Ӧ����SO32-����Na+���������ң�ʹ����Һ����������
��1��SO2�γ�����������ʱ����������Ϳ����е�ˮ��������Ӧ�õ����SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4��
2H2SO4��
��2��������������������Һ�����Ʊ�����������Һʱ��SO2+2OH- =SO32-+H2O��
��3�����ݱ������ݣ���֪��n(SO3��):n(HSO3��)=1:91ʱ����Һ��pHֵΪ���ԣ���NaHSO3��Һ�����ԣ���������������Һ��HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
��4�����ݵ�����ʾ�ı仯����֪HSO3-�������ŵ�ĵ缫��Ӧʽ�ǣ�HSO3-+H2O-2e =3H++SO42-��H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ����������

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ��������������Ӱ�����ǵ��������������е���������������������������������Ҫԭ��֮һ������������������������ж��ַ�����
��1��������Ԫ�طǽ����Խ�ǿ����_____��(��Ԫ�ط��Żش�)
��2��NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ1��ʾ��

����ͼ1��֪SCR�����е�������Ϊ��_________________��
����Fe������ʱ���ڰ�������������£���ͬc(NO)/c(NO2)��Ӧ���ѵ�����ͼ2��ʾ��Ч����ѵ�c(NO)/ c(NO2)=_________��
��3�����᳧���������ռ����շ�������������(NO��NO2)β������������(NO��NO2)���ռ�������գ�����ΪNaNO2��NaNO3��H2O�����к�0.5mol���������β����ǡ�ñ�һ�������25%NaOH��Һ(�ܶ�1.28g/cm3)��ȫ���ա���֪��Ӧ����Һ�к���0.35mo1NaNO2����β����NO��NO2�����ʵ���֮��Ϊ______��(��֪:2NO2+2NaOH=NaNO3+NaNO2+H2O��NO+NO2+2NaOH=2NaNO2+H2O)
��4���ֽ�һ����������ͭ�Ļ�����Ϊ��������4�ݣ��ֱ�����Ũ�Ȳ�ͬ�����ϡ����[���跴Ӧ��ϡ����Ļ�ԭ����ֻ��NO)�����������ڱ�״���µ������ʣ�������������±�:
����������mL) | 100 | 200 | 300 | 400 |
ʣ�������g) | 18.0 | 9.6 | 0 | 0 |
�ų�����������mL) | 2240 | 4480 | 6720 |
����ԭ�����������ͭ�����ʵ�����Ϊ_______________��
����Ŀ�������¶��£����ܵ���ʵı�����Һ�д��ڳ����ܽ�ƽ�⣬��֪��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
KSP(25��) | 8.0��10-16 | 2.2��10-20 | 4.0��10-38 |
25��ʱ������CuSO4��FeSO4��Fe2(SO4)3��0.5mol��1L�����Һ�������ϱ����ݶϣ�����˵������ȷ���ǣ� ��
A. ������Һ�м���������ˮ��������pH��3��4����ˣ��ɻ�ô�����CuSO4��Һ
B. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
C. ����Һ��c(SO42-)��[c(Cu2��)+ c(Fe2��)+c(Fe3��)]��5��4
D. ��pH=5����Һ�У�Fe3�����ܴ�������
����Ŀ��Ϊ�������÷�����������Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ���������Ա������һ�ֻ��������¹��ա�����������ͼ��
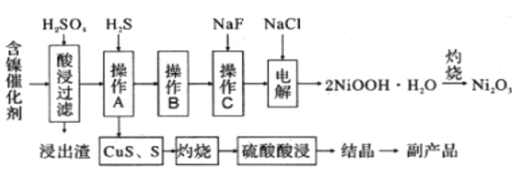
��֪���ٳ����£��й��������↑ʼ�����ͳ�����ȫ��pH���
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
�ڳ����£�Ksp(CaF2)= 2.7��10��11
�ش��������⣺
��1���ӿ�������ʵij��ô�ʩ��_____________����дһ������
��2��д�����ʱFe2O3�����ᷴӦ�����ӷ���ʽ________________________________��
��3����������Ҫ�ɷ�ΪCaSO4��2H2O��______________�������ʡ�
��4������B�Ĺ���������40~50�����H2O2����������___________________________�������ӷ���ʽ��ʾ�����ٵ���PH��3.7~7.7������B�ɳ�ȥ��Һ�е�______Ԫ�أ���Ԫ�����ƣ���
��5������C�ɳ�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10��3mol/L������Һ��c(Ca2+):c(F��) =___________________��
��6���ڼ��������£�������2NiOOH��H2O��ԭ����������
�� Cl�� ������������ΪClO�����������ĵ缫��ӦΪ_____________________��
�� Ni2+ ��ClO����������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ______________��