题目内容
【题目】下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A. 1个 B. 2个 C. 3个 D. 4个
【答案】B
【解析】(1)溶液的导电性与溶液中电荷的浓度有关,溶液中带电离子的浓度越大,导电能力越强,所以若强电解质的浓度很小导电能力会很弱,故正确;(2)一水合氨是弱电解质,稀释促进电离,所以将NaOH和氨水溶液各稀释一倍,NaOH的OH-浓度减少到原来的![]() ,氨水溶液的OH-浓度大于原来的
,氨水溶液的OH-浓度大于原来的![]() ,故错误;(3)醋酸是弱酸,部分电离,如果盐酸的浓度是醋酸浓度的二倍,则盐酸中H+浓度大于醋酸中H+浓度的二倍,故错误;(4)若反应物为固体,减少反应物的用量,平衡不移动,故错误;(5)共价化合物可能为电解质,如HCl等,可能为非电解质,如CO2等,但离子化合物一定是电解质,故正确;(6)氨气、二氧化碳都是非电解质,溶于水生成电解质一水合氨、碳酸,二者电离产生自由移动的离子而导电,故错误;正确的有2个,故选B。
,故错误;(3)醋酸是弱酸,部分电离,如果盐酸的浓度是醋酸浓度的二倍,则盐酸中H+浓度大于醋酸中H+浓度的二倍,故错误;(4)若反应物为固体,减少反应物的用量,平衡不移动,故错误;(5)共价化合物可能为电解质,如HCl等,可能为非电解质,如CO2等,但离子化合物一定是电解质,故正确;(6)氨气、二氧化碳都是非电解质,溶于水生成电解质一水合氨、碳酸,二者电离产生自由移动的离子而导电,故错误;正确的有2个,故选B。

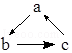
【题目】下列各组物质,不能按图(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A.A
B.B
C.C
D.D
【题目】我们可以通过实验探究来研究化学反应速率的影响因素,
(1)为探讨反应物浓度对化学反应速率的影响,己知:
反应Ⅰ S2O82-+2I-=2SO42-+I2 (慢)反应Ⅱ I2+2S2O32-=2I-+S4O62-(快)
反应 S2O82-+ 2S2O32-= 2SO42-+ S4O62-的反应速率由______________决定(填“反应Ⅰ”、“反应Ⅱ”),I-是此反应的___________________________。
浓度c(S2O82-)反应时间t的变化曲线如下图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)t的变化曲线示意图(进行相应的标注)____________

(2)草酸与高锰酸钾在酸性条件下可以发生化学反应。请补全并配平下面方程式
______H2C2O3+ MnO4-+ =Mn2++CO2+
现有0.00lmol/L的酸性KMnO4溶液和0.0lmol/L的草酸溶液,为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | 温度/℃ | ||
KMnO4 溶液 | 水 | H2C2O4溶液 | ||
① | 4.0 | 0.0 | 2.0 | 25 |
② | 4.0 | 0.0 | 2.0 | 60 |
③ | 4.0 | Vx | 1.0 | 25 |
通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=_________mL,理由是_________________。
对比实验①、②的实验现象是___________________________________。