【题目】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________(填“正向”或“逆向”)进行。
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2 mL 0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加2滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 在稀AgNO3溶液中先加入足量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 常温下,测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
A. AB. BC. CD. D
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
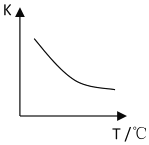
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。