【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为______________________。
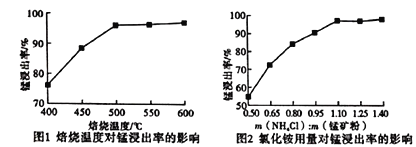
(2)分析下列图1、图2,氯化铵焙烧菱镁矿的最佳条件是:焙烧温度_________,氯化铵与菱镁矿粉的质量之比为_________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式______;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为_________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时,c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为____________________________。
(5)流程中能循环利用的固态物质是____________。
【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
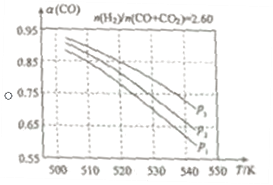
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。