【题目】某学习小组探究Mg与NaHCO3溶液反应的机理,做了如下探究。
实验一:
实验A | 实验B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液。 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水。 |
现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |
(1)实验B的目的是___。
实验二:
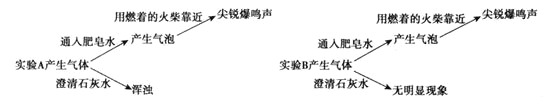
(2)根据实验二,实验A中产生的气体是___。(填分子式)
实验三:分别取少量实验A和B的上层清液于两支试管中,各加入2滴BaCl2溶液,A中立即产生白色沉淀,B中无明显现象。
(3)实验三说明Mg与NaHCO3溶液反应产生了___(填离子符号)。
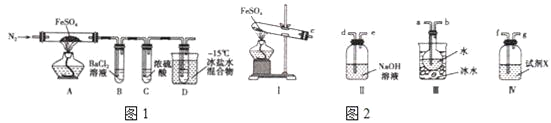
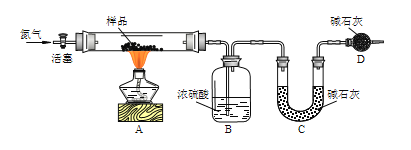
实验四:该小组同学对实验A中产生的白色沉淀做出如下猜测:并用图所示装置进行实验,进一步确定白色沉淀的成分。

猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2xMgCO3]
(4)若用装置A、B组合进行实验,B中有白色浑浊,则猜想___不正确;将装置按A、C、B的顺序组合进行实验,当出现___现象时,猜想3是正确的。
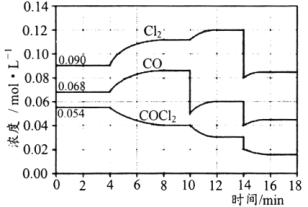
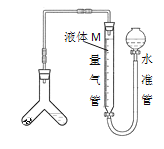
实验五:用图所示装置测定碱式碳酸镁[yMg(OH)2xMgCO3]的组成:
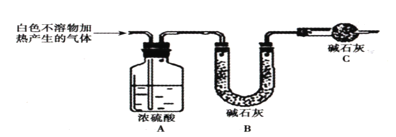
(5)称取干燥、纯净的白色不溶物7.36g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64g。装置C的作用是___,白色不溶物的化学式为___。