【题目】【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
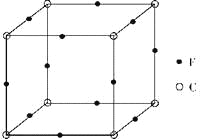
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
|
| ||||
相对分子质量 | 密度/(g/cm-3) | 沸点/℃ | 水中溶解性 | ||
异戊醇 | 88 | 0.8123 | 131 | 微溶 | |
乙酸 | 60 | 1.0492 | 118 | 溶 | |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 | |
实验步骤:在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器B的名称是__。
(2)在洗涤操作中,第一次水洗的主要目的是__;第二次水洗的主要目的是__。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
A.直接将乙酸异戊酯从分液漏斗的上口倒出
B.直接将乙酸异戊酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__。
(5)在蒸馏操作中,仪器试剂的选择及安装都正确的是__(填标号)。
A.  B.
B.
C. D.
D.
(6)本实验的产率是__。
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏__(填“高”或“低”),其原因是__。
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。