题目内容
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
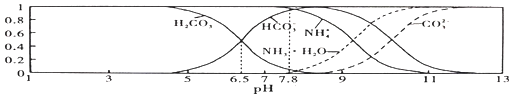
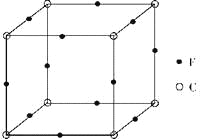
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。
【答案】1s22s22p63s23p63d9 平面三角形 N>O>S H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2 H2O2+CN-+OH-=CO32-+NH3 NaNO2 Cu3N 6
【解析】
A、B、C、D、E、F是原子序数依次递增的前四周期元素,A是宇宙中含量最丰富的元素,所以A是H元素;D与E同主族,且E的原子序数是D的两倍,所以D为O,E为S;B与D组成的化合物是一种温室气体,温室气体是CO2,则B为C;C元素原子最外层P能级比S能级多1个电子,则C为N;F原子的最外层电子数与A相同,其余各层均充满,则F为Cu。
(1)F为Cu,Cu2+的核外电子排布式为1s22s22p63s23p63d9;
(2)E为S,其具有强还原性的氧化物分子是SO2,VSEPR理论:价层电子对=3,成键电子对=2,孤电子对=1,基本构型为三角形,其中孤电子对占据一个顶点,分子构型为V形;
(3)同周期元素,第一电离能从左到右逐渐增大,但N原子的P轨道处于半充满状态,比相邻元素的第一电离能都大,同主族的第一电离能从上到下逐渐减小,所以S、N、O第一电离能由大到小的顺序是N>O>S;
(4)H2O2难溶于CS2的理由是H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2,H2O2能将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-=CO32-+NH3;
(5)在N的氧化物中,NO的相对分子质量最小,体积和物质的量成正比,NO和氧气4:1反应生成NO2,根据2NO+O2=2NO2所以得到等物质的量的NO2和NO的混合物,根据NO2+NO+2NaOH=2NaNO2+H2O,所生成的含氧酸盐的化学式是NaNO2;
(6)该晶胞中Cu原子的个数为12×1/4=3,N原子的个数为8×1/8=1,该化合物的化学式为Cu3N,N离子位于晶胞的顶点,Cu位于晶胞的棱上,所以N离子的配位数是8×3×1/4=6。

 阅读快车系列答案
阅读快车系列答案