题目内容
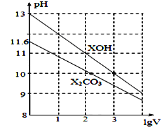
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
【答案】D
【解析】
根据图像,溶液中含有HA,说明HA为弱酸,即存在HA![]() H++A-,加入NaOH溶液,发生NaOH+HA=NaA+H2O,c(A-)/c(HA)比值增大,即
H++A-,加入NaOH溶液,发生NaOH+HA=NaA+H2O,c(A-)/c(HA)比值增大,即![]() ,
,![]() 减小,然后依据溶液中三个“守恒”进行分析;
减小,然后依据溶液中三个“守恒”进行分析;
A、HA为弱酸,即存在HA![]() H++A-,Ka=c(H+)×c(A-)/c(HA),
H++A-,Ka=c(H+)×c(A-)/c(HA),![]() ,时,Ka=c(H+)=10-4.76=10-5+0.24,即数量级为10-5,故A说法正确;
,时,Ka=c(H+)=10-4.76=10-5+0.24,即数量级为10-5,故A说法正确;
B、![]() ,Ka和Kw只受温度的影响,因此该比值保持不变,故B说法正确;
,Ka和Kw只受温度的影响,因此该比值保持不变,故B说法正确;
C、根据电荷守恒,m点所示溶液中:c(H+)+c(Na+)=c(OH-)+c(A-),由A选项分析,m点时,c(A-)=c(HA),因此有c(H+)=c(HA)+c(OH-)-c(Na+),故C说法正确;
D、n点时溶液pH=2,HA的物质的量大于NaOH的物质的量,则此时溶液中:c(Na+)<c(A-)+c(HA),故D说法错误。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。