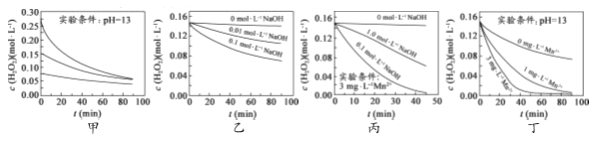
【题目】下列实验操作能达到实验目的的是()
实验目的 | 实验操作 | |
A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
B | 验证乙醇和浓硫酸可以制备乙烯 | 乙醇和浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
C | 比较HClO和CH3COOH酸性 | 用pH试纸测定浓度均为0.1mol/L的HClO溶液和CH3COOH溶液的pH |
D | Mg(OH)2可溶解于饱和NH4Cl溶液 | 将NH4Cl固体与Mg(OH)2混合 |
A.AB.BC.CD.D
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①滴定时边滴边摇动锥形瓶,眼睛应观察___。
②达到滴定终点的标志是___。
③以下操作造成测得样品中氮的质量分数偏高的原因可能是___。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,水未倒尽
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为__。
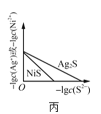
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
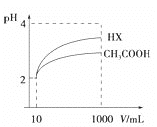
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________